Os pesquisadores descobrem um novo mecanismo de recrutamento de proteínas da família ARF
 p Modelo demonstrando como Arfrp1 e Arl14 são recrutados para as membranas. Crédito:HKUST
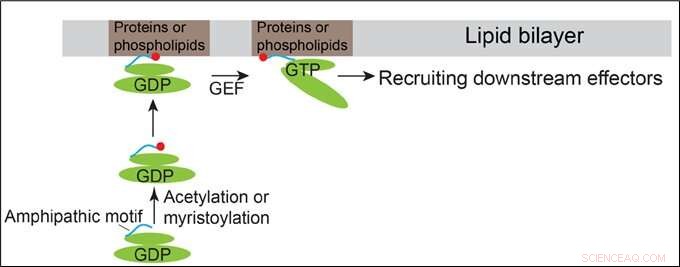
p Modelo demonstrando como Arfrp1 e Arl14 são recrutados para as membranas. Crédito:HKUST
p As pequenas GTPases da família do fator de ribosilação ADP (Arf) são iniciadores-chave de vários processos fisiológicos, incluindo secreção, endocitose, fagocitose e transdução de sinal. As proteínas da família Arf funcionam para mediar o recrutamento de efetores citosólicos para compartimentos subcelulares específicos. Este processo facilita os efetores do Arf para realizar o reconhecimento da carga, modificação lipídica ou outras funções celulares. p O bloqueio das atividades das proteínas da família Arf inibe a secreção de moléculas importantes da célula e também inibe a absorção celular de nutrientes. Defeitos em Arfs ou em suas proteínas regulatórias estão relacionados a várias doenças hereditárias, incluindo deficiência intelectual ligada ao X (XLID), Síndrome de Joubert, Síndrome de Bardet-Biedl e disfunção ciliar. Assim, estudar os mecanismos moleculares das atividades intracelulares reguladas por Arf representa uma oportunidade para compreender a etiologia dessas doenças e desenvolver novas estratégias terapêuticas.
p As proteínas da família Arf fazem um ciclo entre um estado inativo ligado ao GDP e um estado ativo ligado ao GTP. Eles têm organizações estruturais semelhantes contendo um motivo de hélice anfipático N-terminal e os domínios de troca. Os domínios de troca das proteínas Arf se ligam diretamente aos seus fatores de troca de nucleotídeos de guanidina (GEFs), permitindo assim que as proteínas Arf se liguem ao GTP. É geralmente concebido que o recrutamento da membrana das proteínas Arf é iniciado por alterações conformacionais induzidas pela ligação ao GTP das proteínas Arf.
p Além deste mecanismo convencional, O professor Guo e sua equipe descobriram que os motivos anfipáticos do terminal N da proteína da família Arf localizada no Golgi, Arfrp1, e a proteína da família Arf localizada no endossomo e na membrana plasmática, Arl14, são suficientes para determinar localizações subcelulares específicas de uma maneira independente de GTP. A troca dos motivos da hélice anfipática entre essas duas proteínas Arf causa a troca de suas localizações. A determinação espacial mediada pela hélice Arfrp1 requer seu parceiro de ligação Sys1. Além disso, o estudo indica que a acetilação da hélice Arfrp1 e a miristoilação da hélice Arl14 são importantes para a localização subcelular específica. Um modelo proposto representa o recrutamento de membrana de Arfrp1 e Arl14.
p Este estudo revela novos insights sobre a maquinaria molecular que regula a associação de membrana de algumas proteínas Arf, sugerindo que a associação de membrana e ativação de algumas proteínas Arf são desacopladas. Este estudo também oferece novos motivos curtos para direcionar proteínas a localizações intracelulares específicas.
p As descobertas foram publicadas recentemente na revista científica
Journal of Biological Chemistry .
