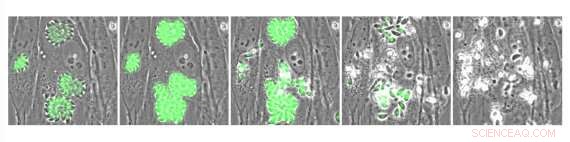
Parasitas de Toxoplasma intracelular que expressam o indicador de cálcio geneticamente codificado GCaMP. Parasitas foram tratados com A23187, um composto que causa o influxo de cálcio e estimula a saída do parasita. Crédito:Whitehead Institute for Biomedical Research
Parasitas apicomplexos infectam centenas de milhões de pessoas em todo o mundo a cada ano. Várias espécies de parasitas apicomplexos do gênero Plasmodium causam malária, enquanto outra espécie apicomplexa, Toxoplasma gondii (T. gondii), causa toxoplasmose, uma doença com sintomas semelhantes aos da gripe que pode ser letal para pessoas com sistema imunológico enfraquecido. Apesar de seu impacto, a biologia desses parasitas causadores de doenças não é muito bem compreendida e as opções de tratamento para infecções são limitadas.
Uma abordagem potencial para tratar a infecção poderia ser drogas que interrompem a sinalização de cálcio dos parasitas, no qual dependem para se espalhar de célula em célula em seus hospedeiros. Os parasitas precisam de um influxo de cálcio para explodir de uma célula hospedeira infectada - um processo chamado egresso - e se mover pelo corpo do hospedeiro e invadir outras células. Em trabalhos anteriores, um pesquisador do laboratório de Sebastian Lourido, membro do Instituto Whitehead, Saima Sidik, testou uma grande coleção de moléculas e identificou uma chamada potenciador 1 (ENH1), que perturbou os níveis de cálcio dos parasitas e impediu a saída, como um promissor chumbo antiparasitário. Contudo, os experimentos originais não determinaram como o ENH1 age. Em pesquisa publicada na revista ACS Chemical Biology em 29 de junho, Alice Herneisen, um estudante de pós-graduação no laboratório de Lourido, e Lourido, que também é professor assistente de biologia no Instituto de Tecnologia de Massachusetts, usou uma abordagem chamada perfil de proteoma térmico para descobrir como o ENH1 impede a saída de parasitas T. gondii. Eles identificaram o principal alvo de ENH1 como uma molécula dependente de cálcio chamada CDPK1 que os parasitas usam para se preparar para a saída, movendo-se entre as células, e invasão de células hospedeiras. O ENH1 liga-se e impede o funcionamento do CDPK1.
"Os avanços nas últimas décadas tornaram muito mais fácil descobrir a atividade potencialmente terapêutica de uma molécula, mas a próxima etapa de descobrir como a molécula funciona muitas vezes ainda é um desafio, "Lourido diz." Ao aplicar novas abordagens expansivas, estamos começando a construir uma imagem mais holística da biologia celular dos parasitas. "
Compreender a biologia responsável pelos efeitos observados de uma droga em potencial é importante porque a maioria das drogas requer modificação antes de estarem prontas para uso humano - pode ser necessário torná-las menos tóxicas, mais potente, ou mais acessível ao ambiente do corpo humano - e esses tipos de modificações não podem ser feitos até que a molécula e sua atividade sejam compreendidas.
Herneisen decidiu usar uma abordagem relativamente nova em parasitas, perfil de proteoma térmico, para descobrir os alvos de ENH1 - as moléculas às quais ele se liga, levando aos seus efeitos terapêuticos. A abordagem funciona traçando um gráfico de como cada uma das proteínas dentro do parasita reage às mudanças no calor com e sem ser exposta ao ENH1. Uma vantagem dessa abordagem é que ela é imparcial, o que significa que, em vez de os pesquisadores escolherem alvos prováveis com antecedência para testar, eles investigam tantas moléculas quanto possível, o que pode levar a descobertas inesperadas. Por exemplo, Lourido tem investigado CDPK1 em outros contextos por muitos anos, e, com base na compreensão anterior de seu laboratório sobre sua função, não seria de se esperar que fosse o alvo principal do ENH1 - essas surpresas podem direcionar a pesquisa para novas direções empolgantes.
Embora CDPK1 seja o principal alvo de ENH1, as investigações não descobriram o alvo que permite ao ENH1 causar oscilações nos níveis de cálcio dos parasitas. Encontrar esse alvo ausente é um dos próximos objetivos do laboratório.
"O fato de ENH1 afetar vários aspectos da sinalização de cálcio pode ser o que o torna um agente antiparasitário tão eficaz, "Herneisen diz." Está mexendo com os parasitas em vários níveis.
A tradução da pesquisa para testes clínicos ainda está muito longe, mas existem vários indicadores de que esta é uma direção promissora para investigação. A sinalização de cálcio não é apenas a chave para o ciclo de vida dos parasitas e capacidade de se espalhar dentro de um hospedeiro, mas as moléculas e mecanismos que os parasitas usam para modular os níveis de cálcio são muito diferentes dos encontrados em mamíferos. Isso significa que uma droga que interrompe a sinalização de cálcio dos parasitas provavelmente não interfere na sinalização de cálcio em pacientes humanos, e assim pode ser mortal para os parasitas sem prejudicar as células dos pacientes.