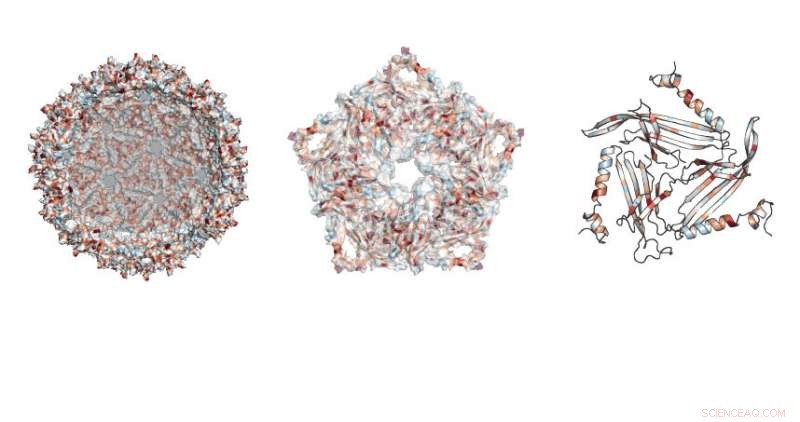
Os pesquisadores estudaram onde as mutações eram permitidas na estrutura semelhante a uma bola de futebol feita pelo andaime MS2. Crédito:Northwestern University
Pesquisadores da Northwestern Engineering desenvolveram uma nova maneira de manipular um invólucro de vírus que se auto-monta a partir de proteínas e é promissor como portador para detecção de doenças, entrega de drogas, e vacinações.
Os vírus têm invólucros construídos para sobreviver em condições adversas, protegendo sua carga até que encontrem uma célula para infectar. A concha pode ser usada para o bem, Contudo, porque essa estabilidade o torna adequado para proteger cargas mais úteis, como medicamentos, que pode ser entregue a células especificamente direcionadas.
A pesquisa se concentrou em uma proteína usada por um vírus bacteriano chamado bacteriófago MS2. Esta proteína pode se automontar, criando uma estrutura inofensiva fora da casca viral, disse Danielle Tullman-Ercek, professor associado de engenharia química e biológica na McCormick School of Engineering.
"Em biologia, tudo tem seu lugar. Biologia é ótima assim - exceto que não conhecemos as regras, "Tullman-Ercek disse." Nossa descoberta foi o método para determinar essas regras de design. "
O estudo, feito em colaboração com o professor de química Matthew Francis e seus colegas da Universidade da Califórnia em Berkeley, levou mais de dois anos. Os resultados foram publicados no dia 11 de abril na revista Nature Communications .
O trabalho permitiu aos pesquisadores examinar quais mutações de proteínas específicas quebraram o esqueleto do vírus ou alteraram as propriedades da estrutura. Fazer isso, a equipe desenvolveu uma nova técnica chamada SyMAPS (Systematic Mutation and Assembled Particle Selection), que separou as proteínas-esqueleto mutadas que permaneceram intactas daquelas que se separaram durante a mutação.
No total, a equipe testou quase 2, 600 versões da proteína, que compõe a casca fechada, andaime semelhante a uma bola de futebol.
"A proteína-esqueleto MS2 tem 129 posições onde podemos fazer substituições, substituindo o aminoácido existente naquela posição por todos os outros aminoácidos, "disse Emily Hartman, um candidato a PhD do quarto ano em química na UC Berkeley e autor principal do artigo. "Ao trocar todos os 20 aminoácidos de ocorrência natural, um por vez, em cada posição na proteína, acabamos testando 20 variáveis em 129 posições. "
A equipe acredita que entender como as mutações mudam a estrutura fornece uma visão importante sobre como essas proteínas de vírus reaproveitadas podem ser usadas na medicina.
"O andaime que você deseja para a entrega da droga pode ser diferente do que você desejaria para uma vacina, "Tullman-Ercek disse." Podemos querer alterar as propriedades da carga na superfície para obter um melhor direcionamento ou adicionar algo ao interior da estrutura, como carregá-lo com um sensor ou gravador de diagnóstico. "
Por exemplo, uma estrutura que se desintegra em um ambiente específico pode ajudar na administração de medicamentos direcionados, como a quimioterapia.
"Uma das coisas que fizemos no estudo foi procurar mutantes sensíveis ao ácido, "Hartman disse." A corrente sanguínea não é ácida, mas uma vez dentro de uma célula cancerosa, é muito mais ácido. Se o andaime desmoronar em ambientes ácidos, isso liberaria a droga dentro de uma célula cancerosa com mais facilidade. "
Uma estrutura menos tolerante a condições ácidas foi encontrada, e a equipe continuará trabalhando nesta área.
Além disso, o estudo oferece uma visão sobre o que pode surgir naturalmente em um vírus mutante, como a gripe. “Isso poderia nos dar uma ideia de quais locais no vírus poderiam ter uma taxa maior de mutação. Essa informação poderia ser usada por cientistas para desenvolver novas vacinas, "Tullman-Ercek disse.
A equipe e seus colegas em ambas as universidades usarão o trabalho como base para aplicativos específicos para o andaime viral, ela disse.
"Este artigo é realmente a primeira etapa de um conjunto maior de histórias, "Hartman disse." Há muito trabalho em andamento nesta colaboração entre as universidades. Estou animado para ver para onde isso vai.
O estudo baseia-se no trabalho anterior de Tullman-Ercek, que descobriu que uma única mutação de aminoácido no mesmo esqueleto do bacteriófago MS2 mudou drasticamente seu tamanho.
Tullman-Ercek atua como membro do corpo docente do Centro de Biologia Sintética da Northwestern. O centro de dois anos reúne cientistas da engenharia, Medicina, física, e ciência da computação interessada em manipular a biologia para ajudar a sociedade. Grande parte da biologia sintética se concentra na mudança de uma célula, alterando seu DNA, criando novos produtos especializados.