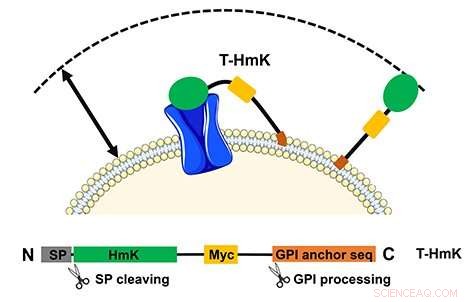
A toxina amarrada (T-HmK) é desenhada livre e ligada a um canal de potássio (azul) expresso na membrana celular. O volume de reação que um T-HmK pode visitar (seta de duas pontas) é determinado pelos comprimentos combinados do ligante de peptídeo flexível, a âncora GPI, e o diâmetro da toxina HmK. O painel inferior mostra o design da construção da expressão. Crédito:UCI School of Medicine
No passado, Peptídeos biologicamente ativos - pequenas proteínas como neurotoxinas e hormônios que agem nos receptores celulares para alterar a fisiologia - foram purificados a partir de fontes nativas como venenos e, em seguida, painéis de variantes foram produzidos em bactérias, ou sintetizado, estudar a base estrutural da interação do receptor. Uma nova técnica chamada varredura zumbi torna esses processos mais antigos obsoletos.
Os peptídeos são usados para terapia médica e para estudar biologia, entre outras coisas, mas seu custo de produção em tempo e dinheiro está cada vez mais alto.
"Se um peptídeo tem 30 resíduos, simplesmente mudar cada site uma vez requer a síntese, purificação e validação da composição dobrada de todas as 30 variantes, um processo que requer meses e muitos milhares de dólares, "disse Steven A.N. Goldstein, MD, Ph.D., vice-reitor para Assuntos de Saúde da Universidade da Califórnia, Irvine, e ilustre professor dos Departamentos de Pediatria e Fisiologia e Biofísica da Escola de Medicina da UCI.
Publicado hoje em Avanços da Ciência , o novo estudo co-liderado por Goldstein e Jordan H. Chill, Ph.D., um professor do Departamento de Química da Universidade Bar-Ilan em Israel, revela como os pesquisadores foram capazes de sequestrar a maquinaria celular para simplificar a criação de peptídeos permitindo extensas, estudos rápidos de estrutura-função e mecanismo para melhorar a especificidade e afinidade de ação, os parâmetros importantes para a eficácia terapêutica.
"Uma vez que sequestramos a maquinaria celular para sintetizar e exibir os peptídeos na superfície da célula com o receptor, nós dublamos essa varredura de zumbis, "disse o primeiro autor Ruiming Zhao, Ph.D., um investigador no laboratório Goldstein.
"Usando esta nova técnica, as mudanças de peptídeos são tão simples quanto a síntese de plasmídeos e requerem apenas alguns dias de trabalho e alguns centavos por construção. Isso nos permite estudar as funções de muitos sites com muitas mudanças em um período de tempo muito mais curto a um custo muito mais baixo. "
O estudo, intitulado, "Neurotoxinas de peptídeo amarrado exibem dois mecanismos de bloqueio no poro do canal de K +, assim como seus análogos não amarrados, "descreve como os peptídeos codificados são ligados por meio de uma via nativa ao exterior da célula em uma corda flexível. Neste caso, o receptor alvo também foi expresso a partir de um plasmídeo e pode ser modificado. O método também permite o estudo de interações de baixa afinidade que, de outra forma, não seriam possíveis de analisar.
Usando a varredura de zumbis, pesquisadores fizeram a descoberta inesperada de que um peptídeo em ensaios clínicos como um supressor imunológico atua de forma diferente do que se pensava, revelando que esta família de neurotoxinas tem dois modos possíveis de interagir com os canais de potássio ao invés de apenas um.
Chill e seu colega Netanel Mendelman, Ph.D., aumentou o impacto dessas descobertas ao elucidar a estrutura tridimensional de uma neurotoxina selecionada usando ressonância magnética nuclear (NMR).
"Estimando centenas de distâncias e ângulos entre os átomos do peptídeo, agora conhecemos sua estrutura, oferecendo um contexto molecular para esses resultados empolgantes, "disse Chill." Os dois modos de ligação parecem envolver uma 'inversão' da toxina ou algum rearranjo de sua estrutura atômica. "
Modos de ligação alternativos, conforme descrito para esses peptídeos, são um fator de confusão problemático no projeto de drogas com base na estrutura, destacando a importância dos achados deste relatório e estudos futuros do processo de reconhecimento entre canais e peptídeos inibitórios.