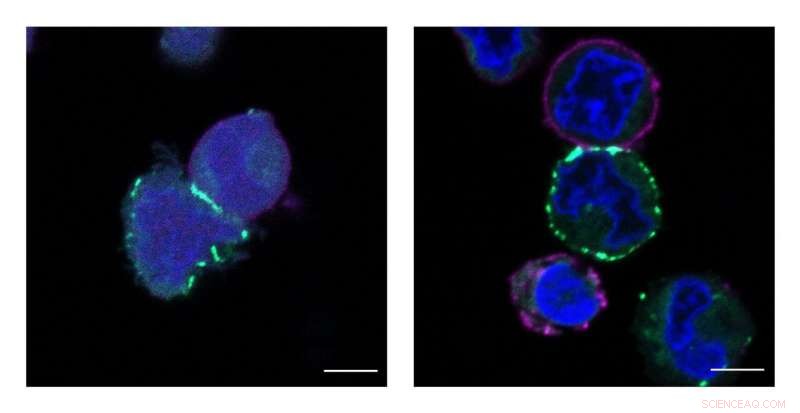
O Grupo MacMillan de Princeton desenvolveu uma nova tecnologia chamada μMap, que identifica os vizinhos mais próximos das proteínas na superfície das células. Essas imagens mostram células sendo rotuladas, ou destacado em verde, pelo catalisador μMap. Crédito:Tamara Reyes-Robles / Merck Exploratory Science Center
Quando os parceiros corporativos da Princeton Catalysis Initiative conversaram há dois anos com David MacMillan, eles apresentaram a ele um desafio biológico no cerne de potenciais medicamentos contra o câncer e outras terapêuticas:quais proteínas na superfície de uma célula se tocam?
O que eles queriam era análogo a um holofote brilhando em uma caverna escura - algo para lançar uma luz metafórica sobre uma proteína e seus vizinhos mais próximos na membrana celular. Grande, moléculas complexas, proteínas são a essência da vida, o próprio fulcro sobre o qual tudo gira sobre nós - a maneira como pensamos, a maneira como crescemos, as doenças que pegamos. As proteínas são capazes de determinar isso enviando mensagens a seus vizinhos. Mas, embora os cientistas pudessem saber quem estava dentro da caverna, eles não sabiam quem estava ao lado de quem, e, portanto, careciam de conhecimento importante sobre essas comunicações essenciais de proteína para proteína.
O Grupo MacMillan do Departamento de Química anunciou na edição atual da Ciência que eles desenvolveram aquele holofote.
A tecnologia inovadora, nomeado μMap pela equipe de pesquisadores de Princeton e cientistas da Merck, usa um fotocatalisador - uma molécula que, quando ativado pela luz, estimula uma reação química - para identificar relações espaciais nas superfícies das células. O catalisador gera um marcador que marca proteínas e seus vizinhos moleculares, o que, por sua vez, permite o mapeamento preciso de seu microambiente.
A tecnologia pode impactar a proteômica, genômica e neurociência, para citar alguns dos campos mais óbvios. Mas as aplicações da biologia fundamental são tão abrangentes que MacMillan, que é James S. McDonnell, Professor de Química da Universidade de Princeton, está ansioso para colocar a tecnologia "nas mãos de todos" para ver o que os cientistas de outras áreas podem fazer.
"Para as tecnologias que temos agora, o problema não é se você pode marcar coisas, "ele disse." O problema é que você pode etiquetar milhares de coisas e então você não pode dizer o que está ali e o que está ao lado. Isso acabou sendo realmente, realmente importante porque as moléculas, proteínas ou enzimas que sinalizam umas às outras geralmente estão próximas umas das outras. Nós vamos, o estado da arte não informa o que está perto. "
Então, eles criaram uma nova abordagem radical.
"Fizemos alguns experimentos críticos e imediatamente pudemos mostrar que estávamos rotulando as coisas a uma distância muito curta, - disse MacMillan. - Agora sabemos exatamente o que há na vizinhança. E isso nunca foi feito antes. Para biologia, vai ser como ligar o interruptor de luz e de repente ver tudo. "
Rob Oslund e Olugbeminiyi Fadeyi, cientistas do Merck Exploratory Science Center (MESC), co-autores do artigo baseados em Cambridge, Massachusetts, disse que a tecnologia pode inspirar novos desenvolvimentos em biologia. "Dado o importante papel de entender as interações de proteínas em microambientes celulares, "Oslund disse, "esta tecnologia tem o potencial de ser uma ferramenta revolucionária para laboratórios de ciências biológicas acadêmicos e industriais em todo o mundo."
O μMap, pronunciado micro-mapa, identifica vizinhos em um raio de 1 a 10 nanômetros em torno de uma proteína específica. (Para referência, um cabelo humano tem cerca de 100, 000 nanômetros de diâmetro.) A resolução neste nível identifica as 10 ou 15 moléculas mais próximas.
Jacob Geri, um pesquisador de pós-doutorado no Merck Center for Catalysis na Princeton University e um co-autor no Ciência trabalho com o estudante de graduação James Oakley e a cientista do MESC Tamara Reyes-Robles, o referido µMap faz isso usando luz azul para alimentar uma reação catalítica.
É assim que funciona:o catalisador - neste caso, um composto de metal orgânico - é seletivamente ligado a qualquer um de cerca de 40, 000 proteínas na superfície de uma célula, onde atua como uma espécie de antena. Luz azul, que tem uma energia fotônica muito alta, serve como o gatilho. Quando brilhou no celular, esta luz azul é captada pela antena, que converte sua energia fotônica em energia química. Essa energia latente não esfria; não se difunde; ele não vagueia sem rumo ao longo da membrana celular, pintando tudo o que encontra. Ele apenas se senta.
Com base em um artigo publicado há cerca de 40 anos, O grupo de MacMillan teve a ideia de empregar o uso de uma molécula orgânica chamada diazirina, que é particularmente receptiva a essa energia latente. Quando uma diazirina se move muito perto do catalisador - dentro de 0,1 nanômetros - a energia química é transferida para a diazirina. A diazirina, por sua vez, reage tão violentamente que libera um subproduto e se torna o que se chama de carbeno, uma espécie "raivosa" que se liga a proteínas vizinhas.
"O catalisador transfere tanta energia que a molécula se separa para expor um átomo de carbono incrivelmente instável, que se manterá em tudo o que puder, "explicou Geri.
O catalisador pode realizar essa reação química muitas vezes, então o processo se repete para todas as moléculas localizadas, proteínas e enzimas. Como os carbenos têm vida tão curta - apenas alguns nanossegundos - sua reação fornece uma sensação vívida, instantâneo em tempo real de todas as moléculas contíguas. Subseqüentemente, os pesquisadores podem construir um mapa preciso do microambiente - exatamente o que os cientistas de tecnologia estavam procurando.
"Muito do mecanismo da doença ocorre através da forma como essas células se comunicam, e eles só podem falar se estiverem se tocando, "disse Geri." É por isso que a superfície da célula é tão importante. Se eles tocam, eles podem se comunicar. "
Ele acrescentou:"Agora podemos descobrir o que está fazendo essa comunicação acontecer ou o que está fazendo essa comunicação mudar. É realmente uma experiência incrível, trabalhando nisso. "
MacMillan's group chose two categories of human cells to investigate. One was a class of proteins that had known interactions, selected as a kind of control group to prove that their interactions could be captured by μMap. The second group was "more interesting, " said Geri. It centered on proteins called PD-L1 and PD-1, which are associated with the body's immune system and its response to cancer cells.
Normalmente, sick cells like cancer cells would present as molecular interlopers that need to be cleared by the immune system. But cancer cells are deceptive, said MacMillan. They send out a "don't kill me" signal through a cloaking mechanism involving the PD-L1 and PD-1 axis. Since cancer therapies are successful partly based on their capacity to block that signal, scientists want to know more about how it is transmitted. Mapping the precise neighborhood is an essential early step. When researchers put the μMap catalyst on PD-L1 and PD-1, the molecules in their micro-environment are tagged. Protein-protein interactions that had previously been hypothesized could now be directly observed. And several correlations were detected that had never been conceived of.
"Agora, we don't do the cancer biology, " said MacMillan. "But we've invented this tool that can give you a lot of information about these cancer cells. We think that by using this information, you can start to target those proteins as a way to also remove interfering signals. And if you can remove those signals, you make your immune system better at going after these cancer cells."
Soon after MacMillan arrived at Princeton, he began driving research in harnessing blue LED light to perform previously impossible feats of chemistry. Merck became involved in 2006, with a seed donation toward MacMillan's research. The company has since donated additional monies, and in 2019 they announced a 10-year funding commitment towards the Princeton Catalysis Initiative, which fosters interdisciplinary collaborations to accelerate the discovery of new research areas.
"Our collaboration created a novel cellular chemistry approach leveraging photoredox catalysis to activate diazirines, an important class of organic molecules, in a temporal-controlled manner, " said Merck's Fadeyi. "Because of the routine use of diazirines within chemical biology and biology, this method will be in high demand not only for protein labeling, but for identifying the binding targets of other biomolecules to elucidate their functional roles."
He added:"The collaboration was successful due to the close interactions between Merck scientists and Dave's lab."
MacMillan likewise lauded the discovery as proof of the value of collaboration across academic and industry lines, like those envisioned when the Princeton Catalysis Initiative first came into being in 2018.
"Como químicos, we don't know any good questions in biology—zero, "ele disse." Então, you're taking these people who know everything about biology, and they have this problem that they're trying to solve. And it's ultimately a great problem for a chemistry group. Ao mesmo tempo, it's not a problem that a chemistry group would ever think about because they don't know biology. You have these two different areas and you put them together and you start to realize there all these great things you can do.
"This is what I love about the social science of science, " he added. "It is absolutely a beautiful example of how it took a village to solve a problem."