Crédito:Zhang et al.
(Phys.org) —Aulas de química de nível inicial aprendem sobre os ácidos de Brønsted-Lowry. Esses ácidos se dissociam em água para formar um H + íon e um contra-íon carregado negativamente. Embora esta seja uma lição fundamental, o mecanismo real de dissolução é um pouco misterioso. O H + molécula se combina com água para formar H 3 O + , mas o número de moléculas de água necessárias para hidratar o ácido mais simples, HF, É desconhecido. Tentativas de isolar HF e H 2 São difíceis, em grande parte devido à alta reatividade do HF e à tendência da água de formar ligações de hidrogênio.
Para entender o mecanismo fundamental por trás da dissolução do ácido, Zhang et al. do Instituto de Pesquisa Química da Universidade de Kyoto HF encapsulado, bem como HF • H 2 O e H 2 O dentro de um C 70 fulereno. Eles descobriram que, a fim de forçar as moléculas para a cavidade de fulereno aberta, as moléculas exigiam "empurrar de fora" usando condições de alta pressão, e "puxando de dentro" por meio de interações moleculares entre HF e H 2 O. Eles foram capazes de identificar como a ligação de hidrogênio ocorria entre essas duas moléculas. O trabalho deles aparece em Avanços da Ciência .
Trabalho anterior de Zhang et al. mostrou que o C 70 o fulereno pode ser aberto em um processo de três etapas que envolve a adição de um derivado de piridazina às ligações alfa ou beta no C 70 . Isso criou uma abertura de anel de 13 membros que formou compostos ligeiramente diferentes, denotado por α-13mem e β-13mem. A desidratação de ambos os compostos resultou em uma abertura do anel de 16 membros. O anel pode ser fechado novamente por meio de hidrólise e um processo de duas etapas.
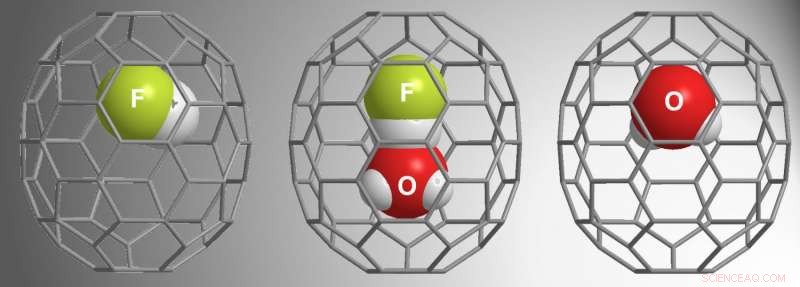
β-16mem era grande o suficiente para capturar H 2 O, mas α-16mem não. Dados esses resultados de estudos anteriores, para o estudo atual, Zhang et al. usou α-16mem para tentar encapsular HF. Em vez de, eles encontraram três possibilidades diferentes dentro dos fulerenos:HF @ C 70 , (HF • H 2 O) @C 70 , e H 2 O @ C 70 .
Suas condições de reação exigiam alta pressão (9.000 atm) para "empurrar" a molécula hóspede para a cavidade α-16mem. Estudos dependentes do tempo mostraram que HF preencheu a cavidade primeiro, seguido por H 2 O • HF, e então H 2 O. Notavelmente, a gaiola aberta não prendeu H 2 O quando HF não estava presente, indicando que a interação entre H 2 O e HF levaram H 2 O encapsulamento. Outros estudos mostraram que HF está "puxando" H 2 O para dentro da cavidade enquanto o ambiente de alta pressão o "empurra" para dentro da cavidade.
Este processo permitiu aos autores estudar a interação entre H 2 O e HF dentro de um ambiente confinado usando 1 H NMR. A análise de NMR mostrou que o (H 2 O • HF) @C 70 foi deslocado para baixo de H 2 O @ C 70 e HF @ C 70 , que indicava ligação de hidrogênio. Além disso, os valores de deslocamento e acoplamento indicaram que o oxigênio estava agindo como o aceitador da ligação de hidrogênio.
Usando difração de raios-x de cristal único, Zhang et al. demonstrou a estrutura do (HF • H 2 O) @C 70 , e relatar a primeira estrutura de raios-x para C duplamente encapsulado 70 . Estas análises e estudos experimentais confirmaram que o H + íon em HF forma uma ligação de hidrogênio linear com o O em H 2 O. Além disso, em comparação com cálculos teóricos de H livre 2 O e HF, os estudos das moléculas encapsuladas revelaram contato próximo com hidrogênio e oxigênio que podem ser característicos do H3O + • F - .
O C 70 derivado de fulereno fornece um excelente nanoambiente para estudar espécies químicas isoladas, algo que não estava disponível para os químicos no passado. Este ambiente isolado permitiu aos autores investigar as interações de dois compostos sem interferência do ambiente circundante e forneceu informações importantes sobre um processo químico onipresente.
© 2017 Phys.org