Crio-microscopia eletrônica:usando tecnologia barata para produzir imagens de alta resolução
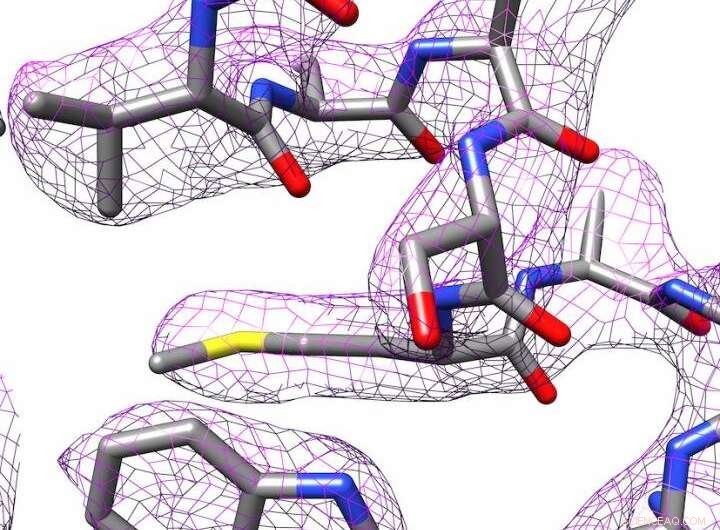 p Estrutura 3D da apoferritina produzida por crio-microscopia eletrônica. Crédito:Panagiotis Kastritis
p Estrutura 3D da apoferritina produzida por crio-microscopia eletrônica. Crédito:Panagiotis Kastritis
p Os bioquímicos da Universidade Martin Luther Halle-Wittenberg (MLU) usaram um crio-microscópio eletrônico padrão para obter imagens surpreendentemente boas que se equiparam às obtidas por equipamentos muito mais sofisticados. Eles conseguiram determinar a estrutura da ferritina quase no nível atômico. Seus resultados foram publicados na revista
PLOS ONE . p A crio-microscopia eletrônica tem se tornado cada vez mais importante nos últimos anos, especialmente ao lançar luz sobre as estruturas das proteínas. Os desenvolvedores da nova tecnologia receberam o Prêmio Nobel de Química em 2017. O truque:as amostras são congeladas rapidamente e depois bombardeadas com elétrons. No caso da microscopia eletrônica tradicional, toda a água é primeiro extraída da amostra. Isso é necessário porque a investigação ocorre no vácuo, o que significa que a água evaporaria imediatamente e tornaria a imagem impossível.
p Contudo, porque as moléculas de água desempenham um papel tão importante nas biomoléculas, especialmente em proteínas, eles não podem ser examinados usando a microscopia eletrônica tradicional. As proteínas estão entre os blocos de construção mais importantes das células e realizam uma variedade de tarefas. É necessário um conhecimento profundo de sua estrutura para entender como funcionam.
p O grupo de pesquisa liderado pelo Dr. Panagiotis Kastritis, que é líder de grupo no Center for Innovation Competence HALOmem e professor júnior no Instituto de Bioquímica e Biotecnologia da MLU, adquiriu um crio-microscópio eletrônico de última geração em 2019. "Não há outro microscópio como este em Halle, "diz Kastritis. O novo Thermo Fisher Glacios 200 kV, financiado pelo Ministério Federal da Educação e Pesquisa, não é o melhor e mais caro microscópio de seu tipo.
p No entanto, Kastritis e seus colegas conseguiram determinar a estrutura da proteína de armazenamento de ferro apoferritina até 2,7 ångströms (Å), em outras palavras, quase até o átomo individual. Um ångström é igual a um décimo de nanômetro. Isso coloca o grupo de pesquisa em uma liga semelhante aos departamentos com equipamentos muito mais caros. A apoferritina é freqüentemente usada como proteína de referência para determinar os níveis de desempenho dos microscópios correspondentes.
p Recentemente, dois grupos de pesquisa quebraram um novo recorde com uma resolução de cerca de 1,2 Å. "Esses valores só podem ser alcançados usando instrumentos muito poderosos, que apenas um punhado de grupos de pesquisa em todo o mundo têm à sua disposição. Nosso método é projetado para microscópios encontrados em muitos laboratórios, "explica Kastritis.
p Os crio-microscópios eletrônicos são dispositivos muito complexos. "Mesmo pequenos desalinhamentos podem tornar as imagens inúteis, "diz Kastritis. É importante programá-los corretamente e Halle tem o conhecimento técnico para fazer isso. Mas a análise que é conduzida depois que os dados foram coletados é tão importante." O microscópio produz vários milhares de imagens, "explica Kastritis.
p Programas de processamento de imagem são usados para criar uma estrutura 3-D da molécula. Em cooperação com o Professor Milton T. Stubbs do Instituto de Bioquímica e Biotecnologia da MLU, os pesquisadores desenvolveram um novo método para criar um modelo de alta resolução de uma proteína. O grupo de pesquisa de Stubbs usa cristalografia de raios-X, outra técnica para determinar a estrutura das proteínas, que requer que as proteínas sejam cristalizadas. Eles foram capazes de combinar uma forma modificada de uma técnica de análise de imagens com as imagens obtidas com o crio-microscópio eletrônico. Isso tornou visíveis os estados de carga e as moléculas individuais de água.
p "É um método atraente, "diz Kastritis. Em vez de precisar de microscópios muito caros, muita capacidade de computação é necessária, que a MLU possui. Agora, além de usar cristalografia de raios-X, A crio-microscopia eletrônica pode ser usada para produzir imagens de proteínas - especialmente aquelas que são difíceis de cristalizar. Isso permite a colaboração, dentro e fora da universidade, na análise estrutural de amostras com potencial médico e biotecnológico.
