Crédito:Wiley
Bactérias resistentes a antibióticos são uma ameaça crescente à saúde, tornando novos antibióticos essenciais. Pesquisadores alemães tiveram recentemente uma descoberta:eles descobriram lugdunin no nariz humano - um novo tipo de peptídeo cíclico que vem da bactéria Staphylococcus lugdunensis e tem fortes propriedades antimicrobianas contra Stahphylococcus aureus, entre outros. Os pesquisadores conseguiram esclarecer o modo de ação sintetizando variantes. Como eles explicam no jornal Angewandte Chemie , o transporte de prótons através das membranas bacterianas está envolvido.
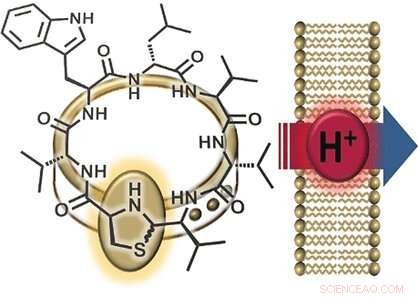
Uma parte interessante da estrutura da lugdunin é seu grupo tiazolidina (um anel feito de um nitrogênio, um enxofre, e três átomos de carbono), que faz parte do seu anel peptídico. Este anel de cinco membros se assemelha a um fecho que "adorna" o anel peptídico. Por esta razão, os pesquisadores nomearam sua nova classe de materiais "fibupeptídeos, "do latim fíbula , significado fecho . Tendo anteriormente obtido sucesso na síntese de lugdunin, a equipe da Universidade de Tübingen e da Universidade de Göttingen (Alemanha) otimizou a via sintética para fazer muitos derivados diferentes dessa substância natural. Isso permitiu um estudo abrangente do mecanismo pelo qual o lugdunin funciona. Os pesquisadores fizeram uma série de derivados em que substituíram cada um dos aminoácidos no anel de peptídeo por alanina - um em que deixaram de lado o "fecho de ornamento, "e um fibupeptídeo com uma estrutura que é a imagem espelhada da lugdunin. Eles então usaram esses derivados para realizar testes de atividade.
O time, consistindo em químicos, bioquímicos, e microbiologistas, descobriram que a estrutura cíclica do peptídeo, o fecho de tiazolidina ", "e dois aminoácidos (triptofano e leucina), são críticos para a atividade antibiótica do composto. Além disso, o anel peptídico deve ser sempre feito de aminoácidos D e L alternados. Contudo, não houve diferença na atividade da molécula original ou sua imagem no espelho. "Isso indica uma falta de interação receptor-ligante estereoespecífico, "afirma Nadine Schilling, um membro da equipe liderada por Stephanie Grond, "em vez de, fala por interação com uma pequena molécula ou íon. "
Uma outra observação foi que os derivados ativos da lugdunina quebram o potencial elétrico (a diferença de voltagem entre o interior e o exterior) das membranas celulares bacterianas, matando assim as bactérias. A incorporação de uma molécula de triptofano adicional intensificou a interação com a membrana e fortaleceu o efeito antibacteriano. Diz Grond:"Esses resultados sugerem o transporte de íons através da membrana bacteriana." Para examinar mais de perto esse recurso, os pesquisadores produziram vesículas sintéticas com um gradiente de pH em relação à solução circundante. A adição de fibupeptídeos ativos levou a uma rápida equalização do pH, sem destruição da membrana ou formação de poros. "O mecanismo consiste claramente na translocação de prótons através da membrana, "diz Grond." Ainda precisamos determinar se lugdunin atua como um transportador móvel ou um canal de prótons. "