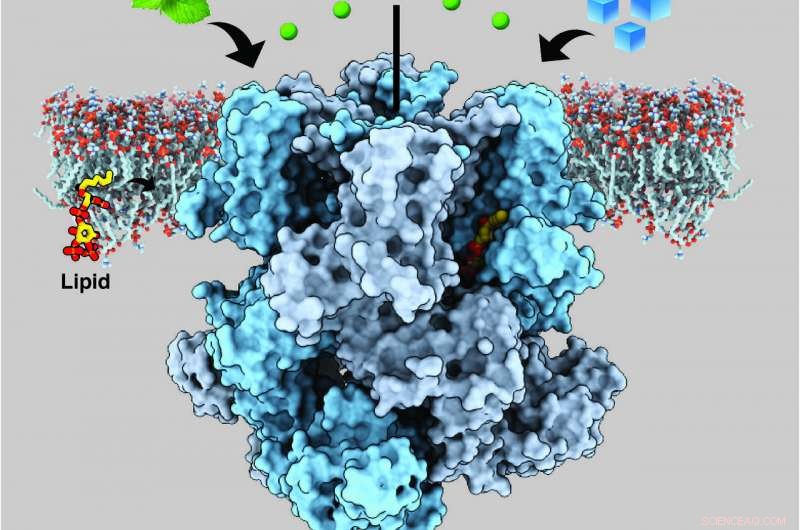
Um canal de íons em células nervosas humanas chamado de potencial receptor transiente membro da melastatina 8 (TRPM8) detecta frieza e mentol, transmitindo sensações de resfriamento pela liberação de cálcio (esferas verdes). Crédito:Ying Yin, Universidade Duke
As pessoas são ótimas em detectar temperaturas frias e também a sensação de frescor induzida por substâncias naturais como o mentol, o que é comum em remédios usados para aliviar os músculos doloridos. Mas não está totalmente claro como fazemos isso.
Cerca de um ano atrás, um grupo de pesquisadores liderado por Seok-Yong Lee, Professor Associado de Bioquímica na Duke University School of Medicine, descobri a arquitetura da proteína humana e animal sensível ao frio, um canal iônico chamado TRPM8, o que lhes deu algumas dicas sobre sua função, mas também levantou mais questões.
Agora, A equipe de Lee determinou a estrutura que o TRPM8 assume quando é ligado ao mentol e a outro agente de resfriamento sintético chamado icilina. As evidências, que aparecerá em Ciência em 8 de fevereiro, pode abrir caminho para novos tratamentos para dor crônica e enxaqueca e ajudar pacientes que sofrem de extrema sensibilidade ao frio.
Na tentativa de entender melhor o TRPM8, Lee e colegas usaram uma técnica chamada microscopia crioeletrônica (cryo_EM), o que é novo para Duke.
A estratégia envolve purificar a proteína das células, congelando-o, e, em seguida, rebatendo elétrons da amostra incrustada no gelo em uma máquina gigante chamada Titan Krios. O crio-EM fez uma composição de imagens de mais de um milhão de partículas de proteína em várias orientações e, em seguida, calculou uma estrutura tridimensional de alta resolução para TRPM8.
A parte mais complicada, de acordo com Lee, estava encontrando uma versão da proteína que fosse estável o suficiente para visualizar sua estrutura. O maior sucesso que eles tiveram foi com canais TRPM8 de um pequeno, pássaro preto e branco chamado de papa-moscas de colarinho, que possui canais semelhantes ao TRPM8 humano. Eles geraram e isolaram a proteína em laboratório, em seguida, misturei-o com mentol ou icilina e PIP2 (fosfatidilinositol 4, 5-bisfosfato), uma molécula lipídica que envia sinais dentro das células e foi anteriormente demonstrado ser necessária para o TRPM8 detectar adequadamente o mentol e a icilina.
A equipe descobriu que o local no TRPM8 onde o mentol e a icilina se ligam é adjacente ao local de ligação do PIP2. A proximidade desses locais de ligação sugere que o PIP2 e os agentes de resfriamento provavelmente cooperam para controlar as mudanças estruturais no TRPM8 que permitem que ele sinalize a detecção de frio enviando sinais elétricos para o cérebro, mas isso ainda é uma questão em aberto.
"Descobrimos a ligação do mentol ao TRPM8, e temos algumas pistas sobre como este canal é aberto, mas ainda não entendemos totalmente como essa ligação mentol é acoplada à abertura do canal, "disse Lee, acrescentando que seu grupo planeja focar em como o canal será aberto no futuro.
No entanto, ele disse, esta e as etapas futuras para obter uma maior compreensão de como o TRPM8 funciona são importantes porque a proteína também é o alvo dos analgésicos, incluindo remédios tópicos que contêm mentol. Embora a ativação normalmente leve ao alívio da dor, em alguns casos, como alodinia fria, onde pequenas sensações, como algumas gotas de água fria na pele, podem causar dor, desligar o canal pode trazer benefícios.