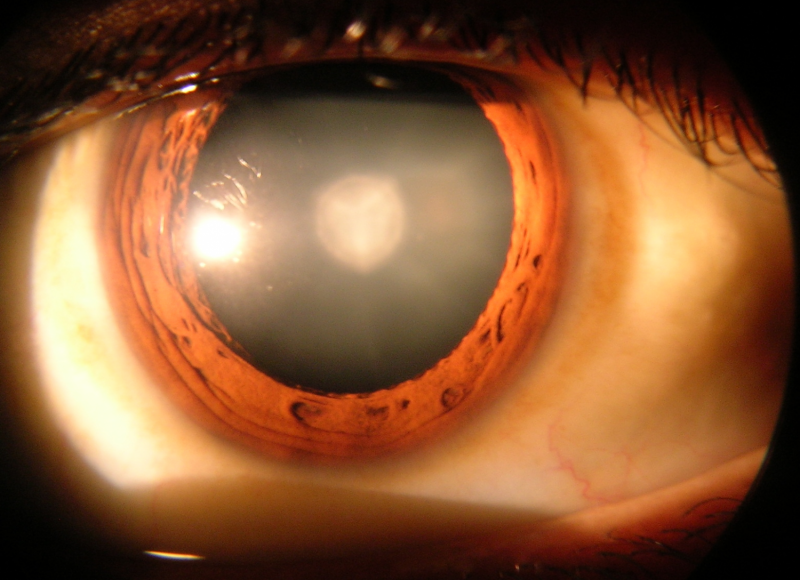
Catarata no olho humano. Crédito:Wikipedia.
Os pesquisadores que trabalham para entender a bioquímica da formação da catarata fizeram uma descoberta surpreendente:uma proteína que por muito tempo se acreditava ser inerte, na verdade, tem uma função química importante que protege o cristalino da formação da catarata.
O cristalino é composto de células repletas de proteínas estruturais chamadas cristalinas. As cristalinas dentro de cada célula da lente formam um gel denso em proteínas, e as propriedades ópticas do gel - como sua transparência e a forma como ele refrata a luz - ajudam a focar a luz na retina.
Mas quando as proteínas cristalinas se agrupam, eles não são mais tão transparentes. Se um número suficiente de proteínas deixar de ser solúvel em água, organização densamente compactada para agregados desordenados, eles começam a espalhar a luz que entra, formando depósitos turvos conhecidos como cataratas.
De acordo com o colega de pós-doutorado de Harvard, Eugene Serebryany, autor principal em um estudo recente no Journal of Biological Chemistry , por muito tempo, os pesquisadores acreditaram que as proteínas cristalinas eram quimicamente inertes. Isso é, exceto para agregar como idades individuais, não se acreditava que as proteínas interagissem muito com outras proteínas. Serebryany disse, "Este era o modelo:a função real (do cristalino) é permanecer monomérico e transparente e evitar a agregação pelo maior tempo possível."
Quando ele era um estudante de graduação no MIT, Serebryany usou uma forma mutante da proteína gama-cristalina do cristalino para imitar o dano UV à proteína. Enquanto estudava como essa mutação leva o cristalino a se agregar em aglomerados, Serebryany encontrou algo surpreendente:o mutante tinha mais probabilidade de se agregar, se do tipo selvagem, ou sem danos, proteína também estava presente.
O professor de Harvard Eugene Shakhnovich, que colaborou com Serebryany e seu orientador de pós-graduação, Jonathan King, nos estudos anteriores, descreveu a descoberta como "um fenômeno bastante impressionante" e explicou:"Se você tivesse essas proteínas danificadas em um tubo de ensaio, eles não se agregariam por um tempo. Se você tivesse a proteína do tipo selvagem, não se agregaria para sempre. Mas então, quando você mistura os dois, você vê uma agregação rápida e precipitada. "
Em outras palavras, a versão saudável de uma proteína que todos pensavam ser inerte estava de alguma forma fazendo com que uma versão ligeiramente danificada ficasse muito pior - e rápido.
Quando Serebryany se formou, Shakhnovich o contratou para continuar trabalhando para entender como uma proteína supostamente inativa poderia causar esse efeito. Serebryany disse, "A primeira coisa que tive que fazer foi basicamente tentar fazer com que os experimentos do meu laboratório de Ph.D. funcionassem neste (novo) laboratório."
"Eles estão a apenas duas paradas de distância no metrô!" Shakhnovich brincou.
Mas, por algum motivo, Serebryany teve problemas para reproduzir os resultados. "É um lugar diferente, é um conjunto diferente de instrumentos, um conjunto ligeiramente diferente de procedimentos. Você vê onde isso vai, "disse ele." De repente, experimentos que eram altamente reproduzíveis antes estavam dando muita variabilidade. "
De fato, no laboratório de Harvard, às vezes, o cristalino de tipo selvagem causou a agregação de cristalino mutante, e às vezes não. Os cientistas ficaram perplexos.
Serebryany disse, "Obviamente, se houver variabilidade repentina, há uma variável oculta que não vimos antes. "Ele montou uma série de experimentos tentando localizar essa variável.
Uma comparação próxima dos pesos moleculares da proteína do tipo selvagem que causou a aglutinação do mutante e da proteína que não revelou uma diferença equivalente ao peso de dois átomos de hidrogênio. Isso deu aos pesquisadores uma dica de que o estado redox - se dois átomos de enxofre dentro de uma molécula de proteína estavam ligados um ao outro em vez de átomos de hidrogênio - pode fazer a diferença.
"Ao realizar experimentos de espectrometria de massa resolvidos isotopicamente, temos mais do que esperamos, "Serebryany explicou." Não apenas o mutante propenso à agregação adquiriu uma ligação dissulfeto interna por molécula durante a reação de agregação, mas a proteína de tipo selvagem promotora de agregação perdeu seu dissulfeto ao mesmo tempo. "
Ao mutar os resíduos de aminoácidos de cisteína contendo enxofre, um a um, em resíduos não contendo enxofre, Serebryany descobriu que dois aminoácidos de cisteína próximos um do outro na superfície da gama-d-cristalina agiam como uma espécie de interruptor. Quando os dois saltam, fazer uma estrutura chamada ligação dissulfeto, O cristalino parecia ser capaz de empurrar outras moléculas danificadas para a agregação. Quando as duas cisteínas não foram ligadas, cada um em vez assumiu um átomo de hidrogênio, explicando a pequena mudança na massa da proteína. Sob essa condição, O cristalino de tipo selvagem era inerte.
Mas como uma ligação entre os aminoácidos na superfície dessa proteína poderia fazer com que outras proteínas se agregassem?
Usando técnicas biofísicas e bioquímicas, a equipe descobriu que, embora a ligação dissulfeto se forme facilmente, também introduz tensão na estrutura da proteína. Isso fez com que cada molécula de proteína passasse ao longo da ligação dissulfeto para uma molécula próxima da proteína, recebendo dois prótons em retorno. Desse modo, a ligação dissulfeto pode ser constantemente passada entre as moléculas de proteína cristalina. Os autores compararam o processo a passar uma batata quente.
Dada uma população inteira de pessoas saudáveis, proteínas cristalinas não danificadas, esse processo pode continuar indefinidamente. Mas se uma proteína já estava um pouco danificada, os autores mostraram, pegou a batata quente com um conjunto diferente de cisteínas, que eram menos capazes de transmiti-lo. Isso fez com que a proteína danificada se acumulasse. O trabalho anterior dos autores revelou que mutações que imitam danos causados por UV alteraram a estabilidade da proteína, tornando-o mais flexível, e, portanto, mais propensos a adquirir a conformação que expõe novas cisteínas que poderiam pegar a batata quente.
Isso nos ajuda a entender a formação da catarata. De acordo com Shakhnovich, a equipe está trabalhando em tratamentos com peptídeos que podem impedir que a "batata quente" alcance as proteínas danificadas. Serebryany espera que esses peptídeos "possam realmente absorver alguns desses dissulfetos e atrasar o tempo que leva para formar as espécies mais propensas à agregação". Isso pode levar à formação de catarata mais lenta para os pacientes.