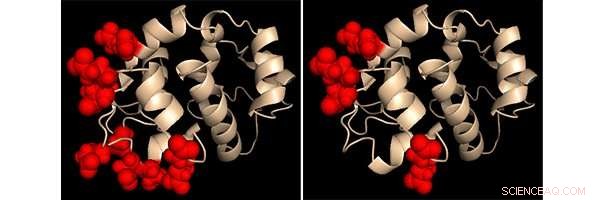
Descrição do químico de proteínas da região sensível ao cálcio em duas variantes da proteína STIM1 projetadas. Os sites que foram alterados são destacados em cada caso como esferas vermelhas. O comportamento dessas duas proteínas projetadas forneceu insights importantes sobre como o STIM1 detecta mudanças nos níveis de cálcio. Crédito:Dr. Patrick Hogan, Instituto La Jolla de Imunologia
Todas as células de mamíferos precisam de um suprimento imediato de íons de cálcio para executar funções tão diversas como a neurotransmissão, contração muscular, liberação de hormônio, ou respostas imunológicas. Esse requisito é tão fundamental que as células se protegem de desastres, armazenando cálcio em uma rede de cisternas intracelulares chamada retículo endoplasmático, ou ER. Então, à medida que as células perdem cálcio como parte de sua rotina diária, os canais se abrem na membrana da célula, permitindo o influxo de cálcio de fora para reencher as reservas de ER e manter as funções celulares impulsionadas pelo cálcio.
Dois estudos publicados recentemente pelos investigadores do Instituto La Jolla de Imunologia (LJI), Patrick Hogan, Ph.D., e Aparna Gudlur, Ph.D. - um artigo publicado no início deste ano em Relatórios de Célula e a outra no dia 31 de outubro, 2018, emissão de Nature Communications - relatar como uma proteína sensível ao cálcio chamada STIM1 sinaliza que é hora de iniciar a recuperação de cálcio e, em seguida, retransmite essa mensagem para seu parceiro, o canal de cálcio ORAI. Este trabalho estabelece as bases para novas maneiras de manipular a sinalização anômala de cálcio no sistema imunológico, particularmente no contexto de doença autoimune ou inflamatória.
"Sabemos há uma década que a proteína STIM1 se moveu em direção à membrana plasmática para abrir os canais ORAI quando os níveis de cálcio do ER caem, "diz Hogan, professor da Divisão de Sinalização e Expressão Gênica. "Nosso trabalho recente mostra como a máquina STIM funciona em um nível molecular. Compreender esses mecanismos é fundamental, já que o cálcio é importante para uma panóplia de respostas imunológicas. "
o Relatórios de Célula papel revela como a proteína STIM1 se alonga à medida que muda de um estado de repouso para um estado ativado quando as reservas de cálcio diminuem. STIM1 é uma proteína transmembrana que se estende pela parede do ER:uma das extremidades cutuca uma cauda semelhante a uma vareta de medição de cálcio dentro da reserva; em um descanso, estado repleto de cálcio, o outro braço se projeta para fora do pronto-socorro, mas permanece dobrado contra a parede do pronto-socorro, fora do alcance dos canais ORA1 dormentes que pontilham a membrana celular.
O grupo definiu o que acontece quando os níveis de cálcio caem, construindo e testando o comportamento das proteínas STIM1 geneticamente modificadas em células em cultura. A análise mostrou que a perda de cálcio da cauda do sensor fez com que as regiões que abrangem a membrana de pares de proteínas STIM1 se agrupassem dentro da parede ER, levando os braços externos a se estenderem em direção à membrana celular. Essa mudança de formato trouxe STIM1 perto o suficiente dos canais ORAI para alcançá-los e abri-los, permitindo que o cálcio flua de volta para as células.
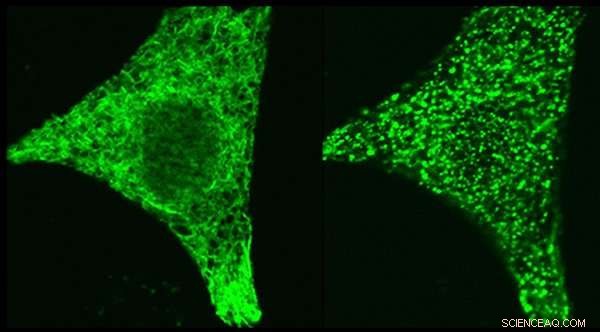
Imagens microscópicas da proteína reguladora STIM1 - rotulada geneticamente com uma etiqueta fluorescente verde - na mesma célula antes da estimulação (painel esquerdo) e após a estimulação (painel direito). STIM1 realoca, quando a célula é estimulada, para locais onde pode bloquear o canal de cálcio ORAI1. O mecanismo que inicia esse movimento STIM1 foi o foco dos dois estudos. Crédito:Dra. Aparna Gudlur, Instituto La Jolla de Imunologia
"O primeiro artigo mostrou como o STIM1 se comunica com uma proteína de canal na membrana plasmática por meio de uma mudança estrutural, "diz Hogan." Nosso artigo mais recente leva esse processo um passo atrás no tempo e revela como a perda de cálcio dentro do ER inicia essa mudança. "
Simplificando, o artigo mais recente concentra-se no funcionamento da vareta de medição de detecção de cálcio do STIM1. Anteriormente, químicos de proteínas descobriram que o cálcio dentro do ER se liga a um motivo estrutural na cauda do STIM1 chamado de "mão EF" e propuseram que, quando a mão estava vazia, ORAI ativado por STIM1. Gudlur, um instrutor no laboratório Hogan e o primeiro autor do novo artigo, explica que não é tão simples. "Agora relatamos que vários cálcio se ligam não apenas à mão EF, mas a outros locais no domínio STIM1 ER, e que os sites dependem uns dos outros, "ela diz." Isso revisa o conceito de como o STIM1 é ativado. "
Não apenas isso, mas de acordo com Hogan, a crença predominante era que a dissociação do cálcio faz com que a região semelhante a uma vareta do STIM1 dentro do ER se desdobre dramaticamente e assuma uma estrutura caótica, uma desordem considerada necessária para a ativação ORAI. "Agora mostramos que quando o cálcio está baixo no ER, essa região não se desenvolve, mas, em vez disso, adquire uma estrutura nova, mas estável, que favorece a interação com o canal ORAI, "Ele diz." Isso é importante porque significa que a interação pode ser direcionada por inibidores.
Na verdade, as empresas farmacêuticas já procuraram desenvolver medicamentos para bloquear os canais de cálcio ORAI como meio de interromper as respostas imunes dependentes de cálcio em doenças autoimunes ou em condições inflamatórias como pancreatite aguda. Alguns medicamentos bloqueadores de ORAI estão atualmente em ensaios clínicos de Fase I e II e, até o momento, parecem não tóxicos. Mas seu potencial terapêutico permanece desconhecido.
Gudlur, que teve um papel de liderança em ambos os estudos, especula que o desenvolvimento de bloqueadores ORAI / STIM1 diretos como terapias pode ser apenas um passo inicial, como ambas as proteínas são comuns a muitos tipos de células. "Direcionar canais ORAI como uma forma de bloquear o excesso de sinalização de cálcio apenas em certas células pode exigir maior especificidade, "ela diz." Nosso trabalho é um primeiro passo na identificação de fatores específicos de células capazes de modular a atividade ORAI / STIM1. Assim que os encontrarmos, triagens de drogas visando esses fatores seriam necessárias. "
Hogan concorda que a descoberta de drogas é construída em uma base de exploração. "Pessoas conduzindo pesquisas básicas devem examinar processos celulares fundamentais, " ele diz, observando que mais de 20 anos se passaram entre a descoberta da proteína do ponto de controle imunológico CTLA4 e a aprovação do FDA do bloqueio do ponto de controle imunológico como tratamento para o melanoma. (Nota:quatro dias após esta entrevista, os "descobridores" nomeados por Hogan receberam o Prêmio Nobel de Fisiologia e Medicina de 2018). "Se você não mexer com o básico de uma célula, nunca vai avançar. Nem sempre sabemos de onde virão as terapias."