Esquema de uma célula bacteriana com um fragmento de uma cadeia metabólica funcionando dentro dela rodeado por glicerol ou sacarose que imita o ambiente intracelular. Crédito:Oleg Sutormin.
Uma equipe do Instituto de Biologia Fundamental e Biotecnologia de SFU usou glicerol e sacarose para simular o ambiente intracelular de bactérias luminescentes e realizou uma série de reações enzimáticas. Eles esperam desenvolver fragmentos de cadeias metabólicas com diferentes comprimentos e estudar reações fermentativas em condições próximas às intracelulares. A pesquisa foi publicada no Catálise Molecular Diário.
Centenas de reações envolvendo enzimas ocorrem constantemente nas células. Para estudá-los com mais detalhes, os cientistas tentam criar modelos experimentais abrangentes do ambiente intracelular. Uma característica interessante de tais modelos de ambiente artificial é a possibilidade de ajustar seus parâmetros para entender como uma determinada reação enzimática reagiria e as diferenças entre as reações enzimáticas em uma célula e aquelas em condições de tubo.
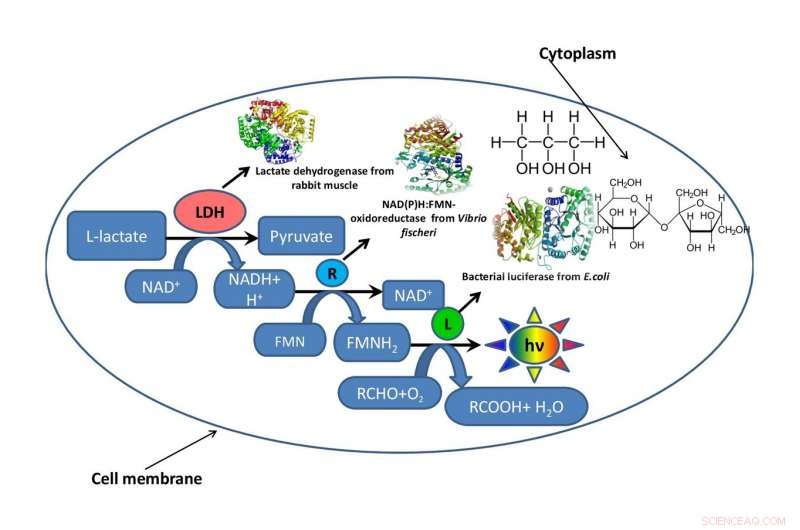
A fim de compreender como a viscosidade da mistura de reação afeta a taxa de processos enzimáticos, uma equipe do Instituto de Biologia Fundamental e Biotecnologia de SFU simulou o ambiente intracelular usando dois solventes orgânicos - glicerol e sacarose. Para testar o efeito da viscosidade da mistura de reação, os cientistas usaram um fragmento de uma cadeia metabólica bioluminescente.
O trabalho consistiu em três etapas. No primeiro estágio, os biofísicos desenvolveram vários sistemas modelo artificiais feitos de glicerol e sacarose com diferentes concentrações de componentes, mas os mesmos níveis de viscosidade do meio de reação. No segundo estágio, eles determinaram como a viscosidade da mistura de reação afetou a velocidade de uma reação enzimática no sistema acoplado de três enzimas:LDH, NAD (P) H:FMN-oxidoredutase, e luciferase. No terceiro estágio, os pesquisadores avaliaram a estabilidade térmica do sistema de enzimas triplas na faixa de temperaturas de 15 a 80 graus.
Como resultado do estudo, os cientistas concluíram que a sacarose limitava a mobilidade das enzimas de forma mais eficiente do que o glicerol. A limitação da mobilidade pode levar a mudanças na taxa de reação ou mesmo no mecanismo. Os pesquisadores recomendam um estudo mais aprofundado do aumento da estabilidade térmica das enzimas em ambientes de mistura de reação viscosa e do aumento da temperatura. Eles também propõem uma abordagem para construir as cadeias metabólicas multi-enzimas celulares dentro da célula luminosa da bactéria.
"Devido ao grande número de reações enzimáticas dentro de uma célula real, para que o processo de metabolismo prossiga rápida e continuamente dentro dele, as enzimas devem ter alta cooperatividade. Portanto, quanto mais alteração da estabilidade térmica das enzimas na presença de viscógenos, melhor será a cooperação dos sistemas enzimáticos estudados dentro das condições da célula real, e quanto maior a possibilidade de um fragmento artificial de uma cadeia metabólica ser natural para uma célula bacteriana. É extremamente importante estudar a influência de solventes orgânicos viscosos na velocidade e estabilidade térmica das reações enzimáticas. A singularidade de nosso estudo é que usamos compostos naturais - glicerol e sacarose que são realmente encontrados na célula real, em contraste com os agentes de aglomeração que são usados em estudos semelhantes por outros pesquisadores, "diz Oleg Sutormin, um co-autor do estudo, e pesquisador associado júnior do Laboratório de Biotecnologias Bioluminescentes da SFU.