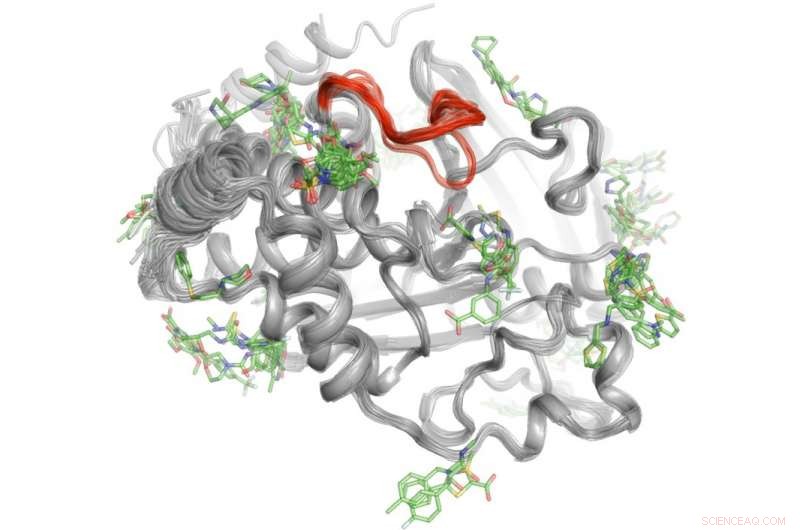
Um método de alto rendimento revela onde mais de 100 pequenas moléculas se ligam à proteína PTP1B. Algumas dessas áreas de ligação podem enviar sinais para o site ativo (vermelho) para controlar a atividade do PTP1B. "Crédito:Daniel Keedy
As proteínas em nossos corpos são estruturas sofisticadas que realizam tarefas específicas para nos manter funcionando e saudáveis. Em muitos casos, essas minúsculas máquinas são ligadas ou desligadas por meio de um processo de duas etapas em que uma parte da proteína envia mensagens para outra parte chamada de "sítio ativo, "desencadeando a proteína para iniciar ou interromper seu trabalho. Às vezes, esse processo - conhecido como alosteria - é interrompido, que leva ou contribui para o desenvolvimento de certas doenças.
Entender como uma proteína é conectada pode ajudar os pesquisadores a desenvolver maneiras de controlar sua atividade, e cientistas do Advanced Science Research Center (ASRC) no The Graduate Center, CUNY, acreditam que encontraram uma maneira confiável de determinar isso, de acordo com um estudo recém-publicado em eLife .
"Assim como é difícil adivinhar como um interruptor de luz é conectado a uma lâmpada em uma sala sem ver por trás das paredes, é difícil prever qual área remota de uma proteína está conectada ao seu local ativo sem ver os detalhes dentro da estrutura, "disse Daniel Keedy, professor assistente da Structural Biology Initiative do ASRC e dos departamentos de química e bioquímica do City College of New York.
Para resolver este mistério, Keedy e seus colegas exploraram as capacidades de sinalização da proteína tirosina fosfatase 1B (PTP1B), que os pesquisadores acreditam ter um papel significativo no diabetes tipo 2 e possivelmente no câncer de mama. Eles primeiro usaram cristalografia de raios-X em diferentes temperaturas para ver como os átomos dentro da proteína se movem. Isso revelou áreas específicas onde os átomos se movem como limpadores de pára-brisa ou um brinquedo de Newton para enviar mensagens. Próximo, a equipe realizou experimentos de alto rendimento com a proteína para determinar quais pequenas moléculas se ligam a esses locais de sinalização.
"Este processo de duas etapas nos permitiu ver não apenas onde a sinalização se origina dentro do PTP1B, mas também quais moléculas pequenas são capazes de enviar mensagens para o sítio ativo. Esse conhecimento pode um dia nos ajudar a desenvolver terapias que enviem mensagens específicas para controlar a atividade de uma proteína e interromper o desenvolvimento de diabetes tipo 2, "disse Keedy.
"Estou bastante interessado nas aplicações potenciais do trabalho de Daniel, "disse Kevin Gardner, diretor da Iniciativa de Biologia Estrutural do ASRC e Professor Einstein de Química e Bioquímica do City College. "Esta técnica fornece uma rota experimental poderosa para perguntar onde pequenas moléculas podem se ligar a alvos proteicos, permitindo a descoberta e o desenvolvimento de drogas, mostrando onde alguém pode ser capaz de encontrar 'pontos de apoio' previamente inesperados para os compostos se ligarem e controlarem a atividade da proteína. "
Keedy e seus colegas até agora olharam apenas para PTP1B, mas seu método usa tecnologias prontamente disponíveis que podem ser usadas para estudar o processo de alosteria em muitas outras proteínas importantes em nossos corpos. Eles esperam obter uma nova compreensão de como as funções dessas outras proteínas são controladas, que pode ser útil para o desenvolvimento futuro de novas terapias medicamentosas.