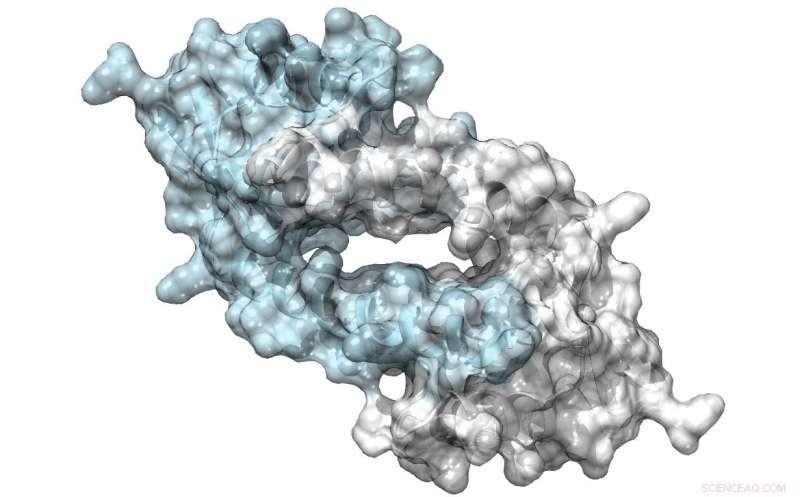
Estrutura de LmrR, uma proteína com um grande poro em sua interface de dímero, que podem se ligar a antibióticos ou recrutar substratos para sofrer catálise. Crédito:Clemens Mayer / Universidade de Groningen
Os químicos da Universidade de Groningen criaram uma nova enzima com um aminoácido não natural como seu centro ativo. Eles produziram a enzima modificando uma proteína de ligação a antibióticos que normalmente atua como um fator de transcrição bacteriano. Outras modificações do sítio reativo podem criar diferentes enzimas para uso em síntese química. Uma descrição da nova enzima foi publicada em Química da Natureza em 2 de julho.
A indústria química está trabalhando muito para substituir os processos convencionais, que pode usar produtos químicos tóxicos ou muita energia, com alternativas mais ecológicas. Uma alternativa popular são as enzimas, que geralmente funcionam na água em temperaturas moderadas. Contudo, o número de reações catalisadas por enzimas naturais é limitado em comparação com o que está disponível em química. "É por isso que o design de enzimas realmente decolou nos últimos anos, "diz o professor de química biomolecular da Universidade de Groningen, Gerard Roelfes.
Catálise aumentada
As enzimas podem ser projetadas de diferentes maneiras. Ainda, até aqui, apenas os 20 aminoácidos de ocorrência natural foram usados para criar o sítio ativo das enzimas. Isso limita o número de reações que essas enzimas projetadas podem realizar, Roelfes argumenta:"Acreditamos que a incorporação de aminoácidos fora do padrão em proteínas poderia expandir significativamente o repertório de enzimas projetadas."
Sua equipe usou um fator de transcrição bacteriana como ponto de partida para seu projeto. A proteína LmrR é um regulador da transcrição na bactéria Lactococcus lactis, que responde a antibióticos; não catalisa reações químicas por si só. É um dímero em forma de donut com uma abertura central que liga as moléculas hidrofóbicas. Usando técnicas de código genético expandido, Roelfes e seus colegas introduziram o aminoácido não natural p-aminofenilalanina na proteína de tal forma que a anilina da cadeia lateral estava presente na abertura central. "A anilina é um catalisador conhecido em síntese química, mas não muito potente. Apresentando-o à proteína LmrR, aumentou a catálise em quase três ordens de magnitude. "

Estrutura da proteína de LmrR o poro. Quando um aminoácido não natural, p-aminofenilalanina, é introduzido neste poro, a atividade catalítica inerente da cadeia lateral da anilina (estrutura vermelha) é aumentada em quase três ordens de magnitude para um modelo de formação de hidrazona. Crédito:Clemens Mayer / Universidade de Groningen
Diferentes reatividades
A nova enzima liga as moléculas orgânicas formando uma estrutura de hidrazona, uma reação que é usada em biotecnologia médica, por exemplo, para acoplar drogas a anticorpos. "Em nossos experimentos, usamos uma reação que dá um produto bem colorido, portanto, poderíamos medir facilmente a atividade da nova enzima. ”Roelfes e sua equipe estão agora modificando a abertura central para aumentar a eficiência da enzima e adaptá-la a reações específicas.
"Existem muitas opções para usar este projeto de enzima em síntese química, "diz Roelfes" E também poderíamos introduzir outros aminoácidos não naturais que têm reatividades diferentes. "Ao combinar essas novas propriedades catalíticas com o sítio de ligação promíscuo da proteína LmrR, Roelfes está confiante de que muitas novas enzimas úteis podem ser criadas.