Os átomos de Au desestabilizam o hidrogênio adsorvido quimicamente, aumentando assim sua energia e reduzindo a barreira. Crédito:2018 Shohei Ogura, Instituto de Ciência Industrial, A Universidade de Tóquio
Materiais que absorvem hidrogênio são usados para armazenamento e purificação de hidrogênio, servindo assim como transportadores de energia limpa. O absorvedor de hidrogênio mais conhecido, paládio, pode ser melhorado misturando-o com ouro.
Uma nova pesquisa liderada pelo Instituto de Ciência Industrial da Universidade de Tóquio explica pela primeira vez como o ouro faz tanta diferença, o que será valioso para o ajuste fino de outras melhorias.
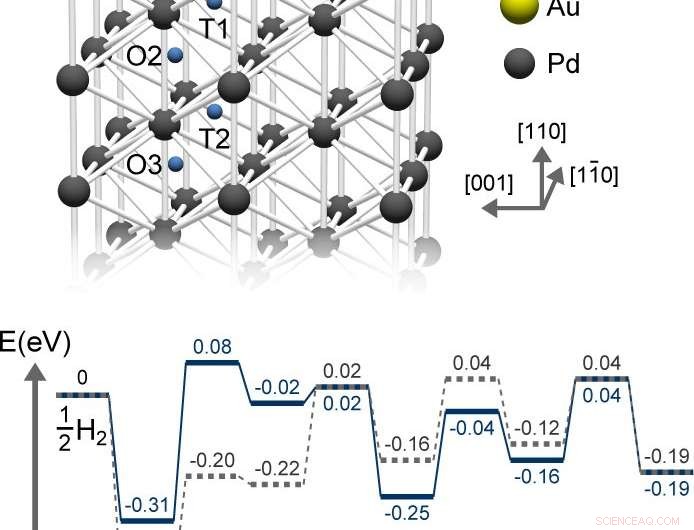
A primeira etapa no armazenamento de hidrogênio é a quimissorção, em que H2 gasoso colide com paládio e adsorve (adere) à superfície. Em segundo lugar, os átomos de H adsorvidos quimicamente se difundem na sub-superfície, vários nanômetros de profundidade. Um artigo recente publicado em Anais da Academia Nacional de Ciências ( PNAS ) relata que o grupo se concentrou nesta segunda etapa lenta, que é o gargalo do processo geral.
Em paládio puro, apenas cerca de 1 em 1, 000 das moléculas de H2 que colidem com o metal são realmente absorvidas para o interior. Portanto, apenas estes podem ser armazenados como portadores de energia. Contudo, quando a superfície do paládio é ligada a ouro, a absorção é 40 vezes mais rápida.
É vital obter a quantidade certa de ouro - a absorção de hidrogênio é maximizada quando o número de átomos de ouro é um pouco menos da metade (0,4) de uma única camada de paládio, de acordo com o estudo. Isso foi descoberto por espectroscopia de dessorção térmica, e por medição de profundidade dos átomos de H usando emissões de raios gama.
"Queríamos saber qual é o papel do ouro, "diz o primeiro autor do estudo, Kazuhiro Namba." Os átomos de ouro estão principalmente na superfície da liga. Contudo, nossos resultados mostraram que o armazenamento de hidrogênio é melhorado mesmo abaixo desta profundidade, em paládio puro. Portanto, o ouro deve estar acelerando a difusão do hidrogênio na superfície, em vez de melhorar sua solubilidade. "
Esta difusão atua como uma reação química típica - sua taxa é determinada pela barreira de energia, isto é, o obstáculo que os átomos de H devem superar para penetrar o paládio. A altura da barreira é a lacuna entre as energias dos átomos de H adsorvidos quimicamente e o estado de transição pelo qual eles devem passar para alcançar o primeiro local sub-superficial.
De acordo com os cálculos da teoria funcional da densidade (DFT), os átomos de ouro desestabilizam o hidrogênio adsorvido quimicamente, aumentando assim sua energia e reduzindo a barreira. Ao tornar a superfície um ambiente menos estável para átomos de H, isso os incentiva a penetrar mais rapidamente em sites mais profundos, em vez de permanecer na superfície. A espectroscopia de fotoemissão sugere que os átomos de ouro empurram a energia dos elétrons do paládio para baixo, enfraquecendo sua capacidade de quimissorver hidrogênio.
Contudo, os átomos de H fracamente adsorvidos por química também têm maior probabilidade de simplesmente serem dessorvidos da superfície; ou seja, retornar à fase gasosa. Este processo indesejado explica por que o armazenamento de hidrogênio é maximizado com apenas 0,4 monocamadas de ouro - se mais ouro for adicionado, a dessorção do hidrogênio ultrapassa sua difusão no paládio.
"Nosso estudo revela, no nível eletrônico, como a liga de ouro controla a absorção de hidrogênio, "diz o co-autor Shohei Ogura." Isso nos ajudará a projetar melhores materiais de armazenamento de hidrogênio, que desempenhará um papel no transporte de energia neutra em carbono, bem como catalisadores sólidos para reações químicas, que muitas vezes dependem do hidrogênio ligado à superfície. "