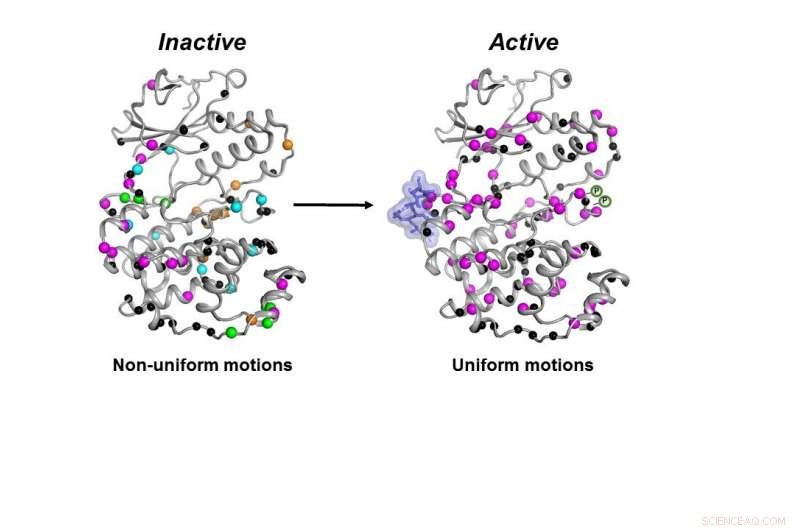
A forma inativa (à esquerda) da enzima MAPK p38 se move de maneira descoordenada. Uma vez que as moléculas necessárias (blob azul e símbolos P) se ligam, a enzima se torna ativa (à direita) movendo-se de maneira coordenada para fazer seu trabalho dentro de uma célula. Crédito:Senthil Ganesan, Departamento de Química e Bioquímica da Universidade do Arizona.
Revelar todas as etapas necessárias para ativar uma enzima chamada proteína quinase pode identificar novas maneiras de direcionar o câncer, de acordo com uma nova pesquisa liderada pela Universidade do Arizona.
Não apenas a quinase deve ter todas as peças necessárias no lugar, a enzima deve se mover da maneira correta e na velocidade correta para funcionar adequadamente em uma célula, os pesquisadores descobriram.
Primeiro autor, Senthil Kumar Ganesan, um professor assistente de pesquisa de química e bioquímica da UA, as referidas quinases são interruptores que ligam ou desligam certos processos celulares. Se as quinases de uma célula parassem de funcionar, a célula morreria.
A equipe liderada pela UA é o primeiro grupo a descobrir o caminho completo para a ativação de uma proteína quinase, disse o autor sênior Wolfgang Peti, que detém a Cátedra Homer C. e Emily Davis Weed em Química da Universidade do Arizona.
"As quinases são um dos principais alvos de drogas contra o câncer, "disse Peti, que também é membro do UA BIO5 Institute e do UA Cancer Center. "Se você sabe como funciona uma quinase, você pode definitivamente projetar melhor seus medicamentos contra ele. "
O desenvolvimento de um medicamento que tire proveito dessa nova descoberta de pesquisa provavelmente levará pelo menos 10 anos, ele disse.
Os medicamentos contra o câncer já em uso que têm como alvo as quinases são dasatinibe e imatinibe para leucemia mieloide crônica e afatinibe para carcinoma pulmonar de células não pequenas, Ganesan disse.
Para assistir uma quinase chamada proteína quinase ativada por mitogênio (MAPK) p38 em ação, os pesquisadores usaram espectroscopia de ressonância magnética nuclear (NMR).
Todas as moléculas necessárias tiveram que se ligar a p38 para que a enzima se tornasse ativa. Só então a enzima poderia se mover corretamente para fazer seu trabalho na célula, os pesquisadores descobriram.
"Descobrimos como ele se move para fazer seu trabalho e qual é a contribuição da velocidade de movimento para o seu trabalho, "Peti disse.
A descoberta sugere que um novo caminho para o desenvolvimento de drogas anticâncer pode ser a criação de drogas que interferem no movimento do p38, ele disse.
"Estamos entusiasmados porque esta quinase pertence a uma família de quinases que são chamadas de quinases MAP - quinases de sinalização chave que regulam uma infinidade de vias (dentro das células), " ele disse.
Peti disse que a nova descoberta pode se aplicar a outras quinases. Ele disse que as muitas enzimas quinase no corpo são muito semelhantes e provavelmente têm caminhos semelhantes para ativação.
Ganesan, Peti e seus co-autores publicaram o artigo, "Ativação dinâmica e regulação da proteína quinase p38 ativada por mitogênio, "na edição de 1º de maio da Proceedings of the National Academy of Sciences .
Seus co-autores são Michael W. Clarkson e Rebecca Page da University of Arizona; Micha B. A. Kunze, Daniele Granata e Kresten Lindorff-Larsen, da Universidade de Copenhague, na Dinamarca; e A. Joshua Wand, da Universidade da Pensilvânia, na Filadélfia.
O National Institutes of Health concedeu NIH-R01GM100910 financiou a pesquisa. Os dados foram coletados nas instalações do UA Molecular Structures Core e Brown University Structural Biology Core.
Uma analogia frequentemente usada para o funcionamento das enzimas é a de uma fechadura e uma chave. Uma molécula particular, a chave, se encaixa em um local da enzima, a fechadura. Assim que a chave estiver na fechadura, a enzima pode começar a funcionar.
A chave na fechadura é necessária para que uma enzima funcione, mas ativar uma enzima nem sempre é tão simples. Alguns cientistas sugeriram que a dinâmica - a maneira e a velocidade com que uma enzima se move - é importante para ativar as enzimas quinase.
Peti está interessado em como moléculas como as quinases governam os processos com as células, então ele queria investigar o papel que a dinâmica desempenha. Aprender mais sobre como as moléculas funcionam dentro das células pode ajudar a desenvolver medicamentos direcionados para combater o câncer e outras doenças.
Descobrir o papel que a dinâmica desempenha na ativação de p38 foi mais difícil e demorou mais do que ele esperava.
A ferramenta que os cientistas usam para observar uma enzima em ação, Espectroscopia de NMR, é mais difícil com uma molécula grande como p38. Além disso, a equipe teve que desenvolver um novo software de computador para analisar os resultados, Peti disse.
Os pesquisadores observaram a enzima em uma série de etapas à medida que várias moléculas-chave se ligavam à p38. Algumas enzimas são ativadas quando as moléculas-chave se ligam - mas não esta.
"Se você acha que é um processo de cinco ou seis etapas ir de zero a 100, pensamos que nas etapas zero, 1, dois ou três, obteríamos indicações ou orientações, "Peti disse.
Isso não aconteceu. Ele disse que os pesquisadores pensaram em desistir.
"Nada estava funcionando, e parecia que nossa hipótese estava completamente errada, " ele disse.
"O que temos é nada acontecendo de zero a um, não há nada acontecendo de um para dois, não há nada acontecendo de dois a três, não há nada acontecendo de três a quatro, "Peti disse." Quando você vai de quatro para cinco:Boom! De repente, estava lá. "
Depois que todas essas etapas foram concluídas, embora a forma de p38 não tenha mudado, sua dinâmica fez, disse ele - e essa mudança final na dinâmica foi necessária para que a enzima funcionasse.
A próxima etapa da equipe, Peti disse, é ver se o movimento das cinases desempenha um papel no diabetes.