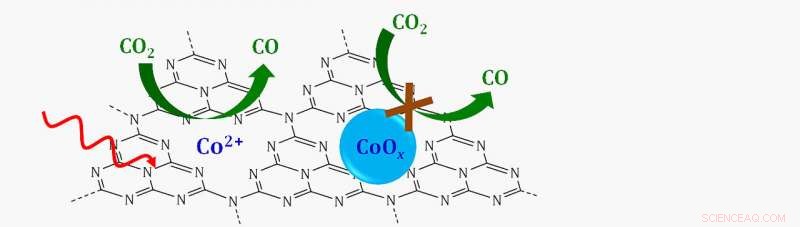
Esquema de um catalisador de sítio único em que íons de cobalto único (CO 2 +) apoiado em uma camada de nitrogênio de carbono grafítico (C3N4) reduz o dióxido de carbono (CO 2 ) a monóxido de carbono (CO) na presença de luz visível (seta vermelha ondulada). Se o cobalto fosse ligado ao oxigênio para formar um óxido de cobalto (CoOx), a reação não continuaria. Crédito:Laboratório Nacional de Brookhaven
Uma equipe de cientistas descobriu um único local, catalisador ativado por luz visível que converte dióxido de carbono (CO 2 ) em moléculas de "blocos de construção" que podem ser usadas para criar produtos químicos úteis. A descoberta abre a possibilidade de usar a luz solar para transformar um gás de efeito estufa em combustíveis de hidrocarbonetos.
Os cientistas usaram a Fonte de Luz Síncrotron Nacional II, uma instalação de usuário do Office of Science do Departamento de Energia dos EUA (DOE) no Laboratório Nacional de Brookhaven, para descobrir detalhes da reação eficiente, que usou um único íon de cobalto para ajudar a diminuir a barreira de energia para quebrar o CO 2 . A equipe descreve este catalisador de local único em um artigo publicado recentemente no Jornal da American Chemical Society .
Convertendo CO 2 em partes mais simples - monóxido de carbono (CO) e oxigênio - tem valiosas aplicações no mundo real. "Ao quebrar o CO 2 , podemos matar dois coelhos com uma cajadada só - remover o CO2 da atmosfera e fazer blocos de construção para fazer combustível, "disse Anatoly Frenkel, um químico com uma nomeação conjunta no Brookhaven Lab e na Stony Brook University. Frenkel liderou o esforço para compreender a atividade do catalisador, que foi feito por Gonghu Li, um físico químico da Universidade de New Hampshire.
"Agora temos evidências de que fizemos um catalisador de local único. Nenhum trabalho anterior relatou CO solar 2 redução usando um único íon, "disse Frenkel.
Quebrando os laços que prendem o CO 2 juntos consomem muita energia e muito tempo. Então, Li decidiu desenvolver um catalisador para reduzir a barreira de energia e acelerar o processo.
"A questão é, entre vários catalisadores possíveis, quais são eficientes e práticos para implementar na indústria? "disse Frenkel.
Um ingrediente chave necessário para quebrar os laços de CO 2 é um suprimento de elétrons. Esses elétrons podem ser gerados quando um material conhecido como semicondutor é ativado por energia na forma de luz. A luz "chuta" os elétrons para fora, por assim dizer, tornando-os disponíveis para o catalisador para reações químicas. A luz solar pode ser uma fonte natural dessa luz. Mas muitos semicondutores só podem ser ativados por luz ultravioleta, o que representa menos de 5% do espectro solar.
"O desafio é encontrar outro material semicondutor onde a energia da luz solar natural fará uma combinação perfeita para expulsar os elétrons, "Frenkel disse.
Os cientistas também precisavam que o semicondutor fosse ligado a um catalisador feito de materiais que podem ser encontrados em abundância na natureza, ao invés de raro, metais caros como a platina. E eles queriam que o catalisador fosse seletivo o suficiente para conduzir apenas a reação que converte CO 2 para CO.
"Não queremos que os elétrons sejam usados para outras reações além da redução de CO 2 , "Frenkel disse.
Íons de cobalto ligados ao nitreto de carbono grafítico (C3N4), um semicondutor feito de carbono, azoto, e átomos de hidrogênio, marcou todas as caixas para esses requisitos.
"Tem havido um interesse significativo no uso de C3N4 como um semicondutor livre de metal para coletar luz visível e conduzir reações químicas, "disse Li." Elétrons gerados pelo C3N4 sob irradiação de luz têm energia alta o suficiente para reduzir o CO 2 . Esses elétrons geralmente não têm vida útil longa o suficiente para permitir que viajem até a superfície do semicondutor para uso em reações químicas. Em nosso estudo, adotamos uma estratégia comum e eficaz para acumular elétrons energéticos suficientes para o catalisador usando um doador de elétrons sacrificial. Essa estratégia nos permitiu focar na catálise de CO 2 redução. Em última análise, queremos usar moléculas de água como doadores de elétrons para nossa catálise, " ele adicionou.
Peipei Huang, um pesquisador de pós-doutorado no laboratório de Li, fez o catalisador simplesmente depositando íons de cobalto em um material C3N4 feito de uréia disponível comercialmente. A equipe então examinou extensivamente o catalisador sintetizado usando uma variedade de técnicas em colaboração com Christine Caputo da University of New Hampshire e Ronald Grimm do Worcester Polytechnic Institute.
O catalisador funcionou em CO 2 redução sob irradiação de luz visível.
"Este catalisador fez o que deveria fazer - quebrar o CO 2 e fazer CO com muito boa seletividade na luz visível, "Frenkel disse." Mas o próximo objetivo era ver por que funcionou. Se você pode entender por que funciona, você pode fazer novos e melhores materiais com base nesses princípios. "
Então, Frenkel e Li fizeram um brainstorming de experimentos que mostrariam a estrutura do catalisador com precisão. Estudos estruturais dariam aos cientistas informações sobre o número de átomos de cobalto, sua localização em relação aos átomos de carbono e nitrogênio, e outras características que os cientistas poderiam ajustar para tentar melhorar ainda mais o catalisador.
Eles se voltaram para a linha de luz de absorção e dispersão rápida de raios-X (QAS) no NSLS-II para usar a espectroscopia de absorção de raios-X. Com a ajuda do cientista líder Steven Ehrlich, O aluno de Frenkel, Jiahao Huang, pegou os dados e analisou os espectros.
Nesta técnica, os raios-x do NSLS-II são absorvidos pelos átomos da amostra, que então ejetam ondas de elétrons. Os espectros mostram como essas ondas de elétrons interagem com os átomos circundantes, semelhante à forma como as ondulações na superfície de um lago são interrompidas quando encontram rochas.
"Ser capaz de fazer espectroscopia de absorção de raios-X (XAS), precisamos sintonizar e escanear a energia do feixe de raios-X que atinge a amostra, "disse Ehrlich." Cada elemento pode absorver raios-x em energias distintas, chamados de bordas de absorção. Na nova linha de luz QAS, podemos escanear a energia dos raios-x através da energia da borda de absorção de diferentes elementos, como o cobalto, neste caso. Em seguida, medimos o número de fótons absorvidos pela amostra para cada valor da energia de raios-X. "
Além disso, Frenkel explicou, "cada tipo de átomo produz um tipo diferente de ondulação eletrônica, quando excitado por raios-x, ou quando atingido por outras ondas, portanto, o espectro de absorção de raios-X indica quais são os átomos circundantes, bem como a que distância e quantos existem. "
A análise mostrou que o catalisador quebrando CO 2 era feito de íons únicos de cobalto rodeados por todos os lados por átomos de nitrogênio.
"Não havia pares cobalto-cobalto. Então, esta era uma evidência de que eles eram na verdade átomos únicos de cobalto dispersos na superfície, "Frenkel disse.
“Esses dados também restringem os possíveis arranjos estruturais, que fornece informações para os teóricos avaliarem e compreenderem totalmente as reações, "Frenkel acrescentou.
Embora a ciência descrita no artigo ainda não esteja em uso prático, existem possibilidades abundantes de aplicativos, Frenkel disse. No futuro, tais catalisadores de sítio único poderiam ser usados em áreas de grande escala com luz solar abundante para quebrar o excesso de CO 2 na atmosfera, semelhante à forma como as plantas decompõem o CO 2 e reutilizar seus blocos de construção para construir açúcares no processo de fotossíntese. Mas em vez de fazer açúcar, os cientistas podem usar os blocos de construção do CO para gerar combustíveis sintéticos ou outros produtos químicos úteis.