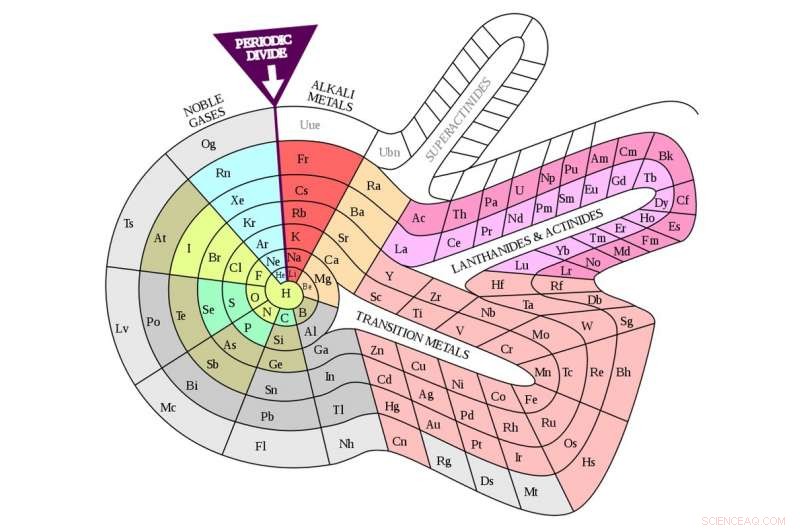
Mesa de espira de Theodor Benfey (1964). Crédito:DePiep / Wikipedia
A tabela periódica olha para baixo das paredes de quase todos os laboratórios de química. O crédito por sua criação geralmente vai para Dimitri Mendeleev, um químico russo que em 1869 escreveu os elementos conhecidos (dos quais eram 63 na época) em cartões e os organizou em colunas e linhas de acordo com suas propriedades químicas e físicas. Para comemorar o 150º aniversário deste momento crucial na ciência, a ONU proclamou 2019 como o ano internacional da tabela periódica.
Mas a tabela periódica não começou realmente com Mendeleev. Muitos tentaram organizar os elementos. Décadas antes, o químico John Dalton tentou criar uma tabela, bem como alguns símbolos bastante interessantes para os elementos (eles não pegaram). E apenas alguns anos antes de Mendeleev sentar-se com seu baralho de cartas feito em casa, John Newlands também criou uma tabela classificando os elementos por suas propriedades.
A genialidade de Mendeleiev estava no que ele deixou de fora de sua mesa. Ele reconheceu que faltavam alguns elementos, ainda a ser descoberto. Então, onde Dalton, Newlands e outros expuseram o que era conhecido, Mendeleev deixou espaço para o desconhecido. Ainda mais surpreendente, ele previu com precisão as propriedades dos elementos ausentes.
Observe os pontos de interrogação em sua tabela acima? Por exemplo, ao lado do Al (alumínio) há espaço para um metal desconhecido. Mendeleev predisse que teria uma massa atômica de 68, uma densidade de seis gramas por centímetro cúbico e um ponto de fusão muito baixo. Seis anos depois, Paul Émile Lecoq de Boisbaudran, gálio isolado e com certeza se encaixou na lacuna com uma massa atômica de 69,7, uma densidade de 5,9g / cm³ e um ponto de fusão tão baixo que se torna líquido em suas mãos. Mendeleev fez o mesmo com o escândio, germânio e tecnécio (que não foram descobertos até 1937, 30 anos após sua morte).

Lista de elementos de John Dalton. Crédito:Wikimedia Commons
À primeira vista, a mesa de Mendeleev não se parece muito com aquela que conhecemos. Por uma coisa, a mesa moderna tem um monte de elementos que Mendeleev ignorou (e não deixou espaço para), mais notavelmente os gases nobres (como o hélio, néon, argônio). E a mesa é orientada de forma diferente para nossa versão moderna, com elementos que agora colocamos juntos em colunas organizadas em linhas.
Mas, uma vez que você dá uma volta de 90 graus na mesa de Mendeleev, a semelhança com a versão moderna torna-se aparente. Por exemplo, os halogênios - flúor (F), cloro (Cl), bromo (Br), e Iodo (I) (o símbolo J na tabela de Mendeleev) - todos aparecem um ao lado do outro. Hoje eles estão dispostos na 17ª coluna da tabela (ou grupo 17, como os químicos preferem chamá-lo).

A mesa de Dimitry Mendeleev completa com elementos ausentes. Crédito:Wikimedia Commons
Período de experimentação
Pode parecer um pequeno salto deste para o diagrama familiar, mas, anos após as publicações de Mendeleev, houve muita experimentação com layouts alternativos para os elementos. Mesmo antes de a mesa ter seu ângulo reto permanente, o pessoal sugeriu algumas reviravoltas estranhas e maravilhosas.
Um exemplo particularmente notável é a espiral de Heinrich Baumhauer, publicado em 1870, com hidrogênio em seu centro e elementos com massa atômica crescente espiralando para fora. Os elementos que caem em cada um dos raios da roda compartilham propriedades comuns, assim como aqueles em uma coluna (grupo) o fazem na tabela de hoje. Havia também a formulação um tanto estranha do "haltere" de 1892, de Henry Basset.
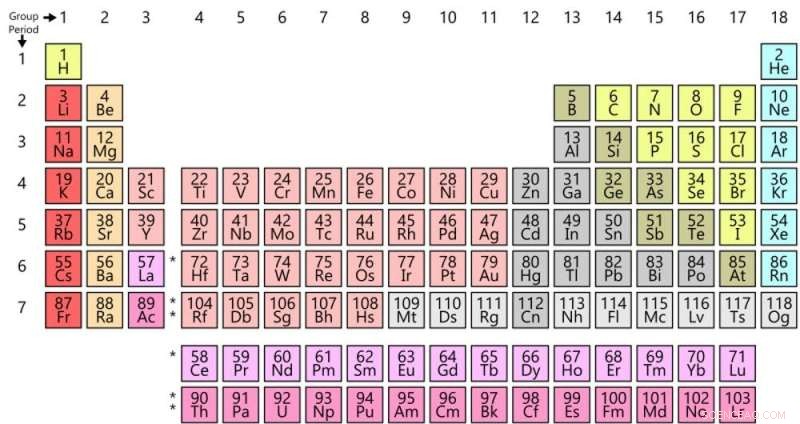
Tabela periódica de hoje. Crédito:Offnfopt / Wikipedia
No entanto, no início do século 20, a mesa tinha se acomodado em um formato horizontal familiar com a versão de aparência surpreendentemente moderna de Heinrich Werner em 1905. Pela primeira vez, os gases nobres apareceram em sua posição agora familiar na extrema direita da mesa. Werner também tentou tirar uma folha do livro de Mendeleev, deixando lacunas, embora ele tenha exagerado na suposição com sugestões de elementos mais leves que o hidrogênio e outro situado entre o hidrogênio e o hélio (nenhum dos quais existe).
Apesar desta mesa de aparência bastante moderna, ainda havia um pouco de reorganização a ser feito. Particularmente influente foi a versão de Charles Janet. Ele adotou a abordagem de um físico para a mesa e usou uma teoria quântica recém-descoberta para criar um layout baseado nas configurações eletrônicas. A tabela do "passo esquerdo" resultante ainda é a preferida por muitos físicos. Interessantemente, Janet também forneceu espaço para elementos até o número 120, apesar de apenas 92 serem conhecidos na época (estamos apenas em 118 agora).

A espiral de Heinrich Baumhauer. Reimpresso (adaptado) com permissão de Tipos de classificações gráficas dos elementos. III. Espiral, helicoidal, e gráficos diversos. Crédito:G. N. Quam, Mary Battell Quam. Copyright (1934) American Chemical Society.
Estabelecendo-se em um design
A mesa moderna é na verdade uma evolução direta da versão de Janet. Os metais alcalinos (o grupo coberto pelo lítio) e os metais alcalino-terrosos (no topo do berílio) foram deslocados da extrema direita para a extrema esquerda para criar uma tabela periódica de aparência muito ampla (forma longa). O problema com esse formato é que ele não se encaixa bem em uma página ou pôster, então, principalmente por razões estéticas, os elementos do bloco f são geralmente cortados e depositados abaixo da mesa principal. Foi assim que chegamos à mesa que reconhecemos hoje.
Isso não quer dizer que as pessoas não tenham mexido nos layouts, frequentemente como uma tentativa de destacar correlações entre elementos que não são facilmente aparentes na tabela convencional. Existem literalmente centenas de variações (verifique o banco de dados de Mark Leach) com espirais e versões 3-D sendo particularmente populares, para não mencionar mais variantes irônicas.
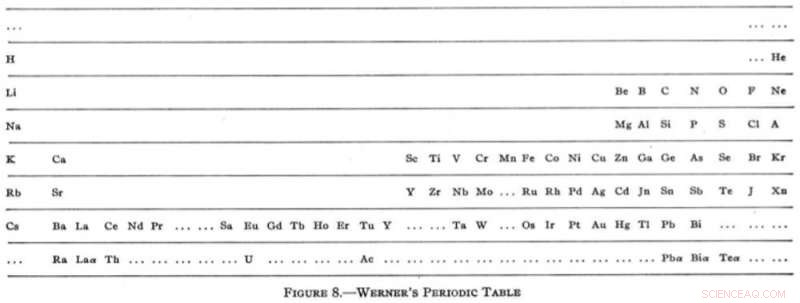
A encarnação moderna de Heinrich Werner. Reimpresso (adaptado) com permissão de Tipos de classificações gráficas dos elementos. I. Introdução e tabelas curtas, G. N. Quam, Mary Battell Quam. Crédito:American Chemical Society (1934)
Que tal minha própria fusão de dois gráficos icônicos, A tabela de Mendeleev e o mapa do metrô de Londres de Henry Beck abaixo?
Ou a estonteante variedade de imitações que visam dar um toque científico à categorização de tudo, desde cerveja a personagens da Disney, e meu particular favorito "absurdo irracional". Tudo isso mostra como a tabela periódica de elementos se tornou o símbolo icônico da ciência.

Mesa esquerda de Charles Janet. Crédito:Wikipedia, CC BY-SA

Versão 3D da mesa com "flor de Mendeleev". Crédito:Тимохова Ольга / Wikipedia, CC BY-SA
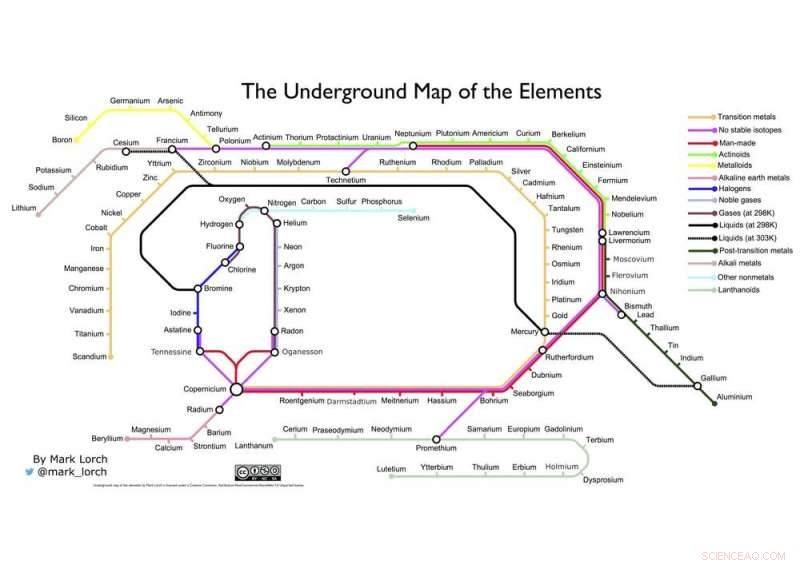
O mapa subterrâneo dos elementos do autor. Crédito:Mark Lorch, Autor fornecido
Este artigo foi republicado de The Conversation sob uma licença Creative Commons. Leia o artigo original. 