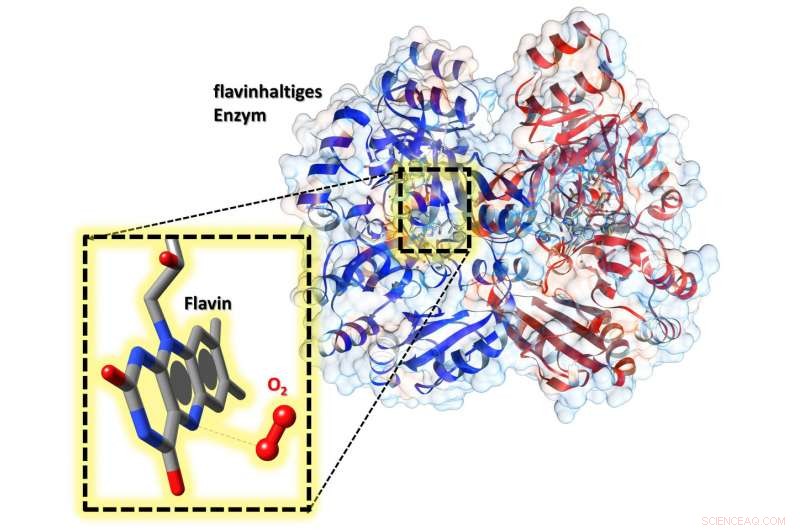
No centro ativo da enzima está um cofator de flavina. Na ampliação, podemos ver que perto dele, oxigênio (O 2 ) está vinculado - permitindo que o flavin seja ativado. Crédito:Robin Teufel, Raspudin Saleem-Batcha
Em células humanas, vitaminas costumam servir como precursores de cofatores - não proteínas que são uma parte essencial das enzimas. Entre eles estão os flavinas, derivado da vitamina B2.
Uma equipe chefiada pelo Dr. Robin Teufel e Dr. Raspudin Saleem-Batcha da Universidade de Freiburg no Centro de Análise de Sistemas Biológicos agora mostrou em detalhes como o oxigênio interage com a flavina em uma enzima - revelando pela primeira vez precisamente como ele trabalho. Os pesquisadores publicaram seus resultados no último Proceedings of the National Academy of Sciences (PNAS) .
Os flavinas desempenham um papel fundamental nos processos metabólicos, no sistema imunológico e no desenvolvimento neural em humanos - e são igualmente importantes para as bactérias, fungos e plantas. Flavoenzimas geralmente requerem oxigênio para funcionar. Mas até agora, muitos dos detalhes de sua interação não eram conhecidos.
Os pesquisadores usaram a análise de difração de raios-X para mostrar pela primeira vez que o oxigênio está ligado a uma bolsa especial dentro da enzima. A natureza desse composto torna possível ativar o cofator - tornando-o essencial para o funcionamento da enzima. Esse conhecimento pode ajudar, por exemplo, para modificar racionalmente as flavoenzimas no futuro - na pesquisa básica ou para aplicações biotecnológicas.