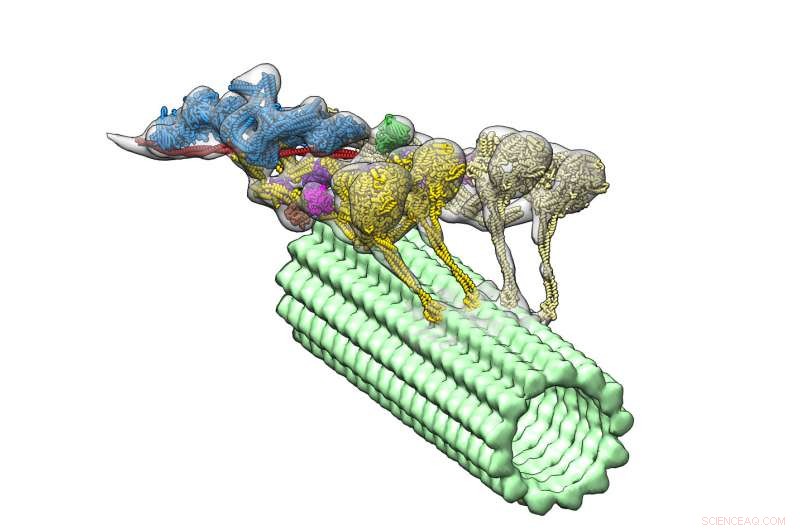
Os motores do complexo dineína-dinactina (multicolorido) descem por um microtúbulo (verde). Os quatro domínios motores são mostrados em amarelo. Dynactin (azul) fornece a estrutura para manter as duas dineínas juntas. Crédito:Danielle Grotjohn, Lander Lab
Na rodovia celular, proteínas motoras chamadas dineínas governam a estrada. Dineínas "caminham" ao longo de estruturas chamadas microtúbulos para entregar carga celular, como moléculas de sinalização e organelas, para diferentes partes de uma célula. Sem dinein no trabalho, as células não podem se dividir e as pessoas podem desenvolver doenças neurológicas.
Agora um novo estudo, que aparece no jornal Nature Structural &Molecular Biology , fornece a primeira visualização tridimensional (3D) do complexo dineína-dinactina ligado aos microtúbulos. Os líderes do estudo do The Scripps Research Institute (TSRI) relatam que uma proteína chamada dinactina une duas dineínas, como uma canga prendendo um par de cavalos de tração.
"Se você quiser que uma parelha de cavalos se mova em uma direção, você precisa alinhá-los, "diz Gabriel C. Lander, PhD, um professor associado da TSRI e autor sênior do estudo. "Isso é exatamente o que a dinactina está fazendo com as moléculas de dineína."
Compreender como o complexo dineína-dinactina é montado e organizado fornece uma base crítica para explicar as causas subjacentes de várias doenças neurodegenerativas relacionadas à dineína, como atrofia muscular espinhal (SMA) e doença de Charcot-Marie-Tooth (CMT).
Os pesquisadores sabiam que a dinactina é necessária para a dineína mover a carga, mas eles lutaram para obter uma imagem completa de como as diferentes partes do complexo funcionavam juntas.
"Sabíamos que a dineína só se torna ativa quando se liga a um parceiro chamado dinactina. O problema era que, historicamente, foi difícil resolver esta estrutura porque é muito flexível e dinâmica, "explica Danielle Grotjahn, um estudante de pós-graduação da TSRI e co-autor do estudo. "Precisávamos visualizar esses complexos dineína-dinactina para entender fundamentalmente como funcionam para transportar moléculas."
Para o novo estudo, pesquisadores usaram uma técnica de imagem chamada tomografia crioeletrônica, que é semelhante a adquirir uma tomografia computadorizada de uma proteína, para produzir uma reconstrução 3D, ou tomograma. Para aumentar a resolução e clareza desses tomogramas, os pesquisadores usaram algoritmos computacionais avançados para calcular a média de muitos complexos de proteínas individuais.
Nesse caso, Contudo, os métodos de processamento atuais não foram capazes de produzir um claro, estrutura 3D interpretável do complexo dineína-dinactina extremamente flexível.
Grotjahn sabia que as informações necessárias estavam escondidas nos tomogramas, então, ela desenvolveu uma nova estratégia para identificar componentes específicos do complexo dineína-dinactina. Essa abordagem ajudou a guiar o software de processamento de imagem para reconstruir todo o complexo motor ligado aos microtúbulos.
"Danielle estava dando o primeiro grande passo para os algoritmos computacionais, "diz Lander.
Com seu novo, estrutura detalhada, os pesquisadores notaram uma característica surpreendente:o complexo tem duas moléculas de dineína onde eles esperavam ver apenas uma. Isso significa que, porque cada dineína tem dois domínios motores, o complexo dineína-dinactina tem quatro domínios motores no total.
"Esta descoberta foi totalmente inesperada, e vai mudar a forma como este complexo motor é representado em livros de biologia celular e bioquímica, "diz Saikat Chowdhury, PhD, um associado de pesquisa TSRI e co-autor do estudo.
"Houve anos de experimentos biofísicos e experimentos bioquímicos, e sempre foi assumido que havia apenas uma molécula de dineína, "Lander acrescenta.
Os pesquisadores também puderam ver onde a dinactina se encaixa. Eles descobriram que a molécula fornece uma estrutura estável, unindo a equipe de domínios motores e ativando sua capacidade de se mover ao longo dos microtúbulos. Esta descoberta ajuda a explicar como a dineína pode transportar grandes cargas, como organelas que são muito maiores do que elas, em longas distâncias em um ambiente celular lotado.
A abordagem de processamento de imagem usada neste estudo tem o potencial de ser extremamente útil para resolver as estruturas de outras grandes, proteínas flexíveis.
"Agora somos capazes de superar os modelos de desenho animado e visualizar os detalhes de muitos complexos macromoleculares dinâmicos, "diz Grotjahn." À medida que aprendemos mais sobre a organização 3D e a arquitetura dessas máquinas moleculares, estaremos melhor equipados para entender como funcionam mal nas doenças. "
Autores adicionais do estudo, "A tomografia crioeletrônica revela que a dinactina recruta uma equipe de dineínas para a motilidade progressiva, "foram Yiru Xu do The Scripps Research Institute; Richard J. McKenney da University of California, Davis; e Trina A. Schroer, da Universidade Johns Hopkins.