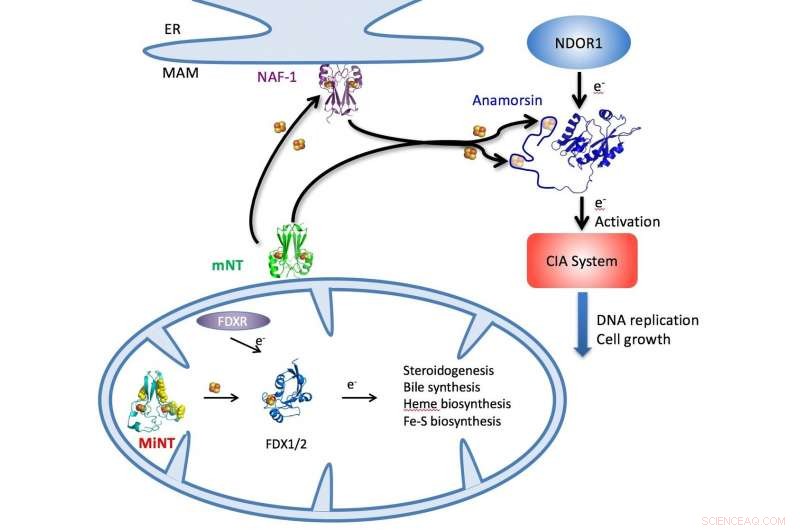
Uma ilustração descreve o ciclo NEET em células pelas quais os aglomerados de ferro-enxofre são entregues por MiNT, mitoNEET (mNT) e proteínas NAF-1 no citosol ou na mitocôndria (parte inferior) para uma série de processos metabólicos celulares, incluindo a síntese de ATP. Crédito:Patricia Jennings / Universidade da Califórnia em San Diego
Uma proteína de duas faces em uma cadeia que regula o ferro e outros elementos nas células pode fornecer um novo alvo para o tratamento do câncer, diabetes e outras doenças.
Uma equipe de pesquisadores da Rice University, a Universidade da Califórnia em San Diego (UCSD), a Universidade Hebraica de Jerusalém e a Universidade do Norte do Texas detalharam a estrutura de uma proteína chamada NEET mitocondrial interna (MiNT), parte de uma via que estabiliza as mitocôndrias, as organelas que produzem energia para as células.
O relatório deles aparece esta semana no Proceedings of the National Academy of Sciences .
MiNT é diferente de seus primos, as proteínas NEET mitoNEET e NAF-1, mas todos eles desempenham um papel na progressão do câncer, diabetes, doenças neurodegenerativas e envelhecimento. As proteínas NEET têm sido o foco da equipe que relatou anteriormente sua importância na ligação de aglomerados tóxicos de ferro e enxofre nas células e como um possível alvo para o tratamento do câncer de mama.
No novo estudo, os pesquisadores liderados pelos colaboradores de longa data Patricia Jennings da UCSD e José Onuchic do Centro de Física Teórica Biológica de Rice (CTBP) foram os primeiros a detalhar a estrutura cristalina do MiNT, também conhecido como CISD3, que reside dentro das mitocôndrias.
Jennings e sua equipe produziram a estrutura molecular. Com isso, eles foram capazes de mostrar que, embora MiNT compartilhe algumas características com outras proteínas ferro-enxofre na família NEET, existem diferenças significativas que provavelmente o tornam o mais potente dos três.
MitoNEET e NAF-1 (também conhecido como CISD1 e CISD2, respectivamente) são dímeros, proteínas com duas semelhantes, monômeros conectados que residem no citosol, o fluido dentro das células. Mas MiNT é um monômero que vive exclusivamente dentro das mitocôndrias, onde coleta aglomerados de ferro-enxofre entregues por outros NEETs e os distribui para facilitar, entre outras coisas, a síntese de trifosfato de adenosina (ATP), a molécula que transporta energia através das células para permitir processos metabólicos.
MiNT também difere por mostrar dois lados de seu ambiente, um hidrofóbico (repelente de água) e o outro hidrofílico (que atrai água). "Porque é um monômero, cada lado é diferente, então vai interagir com diferentes proteínas, e você pode ser capaz de direcioná-lo com drogas diferentes em cada lado, "disse Jennings, afiliado do CTBP e professor de química e bioquímica na UCSD.
"É mais rápido e eficiente do que os outros NEETs, "disse Onuchic, cujo laboratório construiu simulações de computador para estudar a dinâmica de dobramento do MiNT. “Seria muito perigoso ter uma proteína como essa no citosol;
é por isso que é restrito dentro das mitocôndrias, onde ocorrem muitos processos bioenergéticos. "
Os pesquisadores disseram que o MiNT é essencial para o equilíbrio das espécies reativas de ferro e oxigênio (ROS) nas mitocôndrias. "O ferro é tóxico, "Jennings disse." Muito disso na cela é ruim. Devemos, portanto, controlá-lo em nossos corpos porque é muito importante para a regulação da energia e fundamental para a saúde e as doenças.
“Com a estrutura do MiNT, podemos começar a entender o circuito regulatório completo que controla os clusters ferro-enxofre e ROS que não foram reconhecidos antes, ", disse ela." Podemos começar a ver como essas proteínas regulam o fluxo para dentro e para fora da mitocôndria. "
O papel do MiNT na produção de ATP pode torná-lo um alvo eficaz para o encolhimento de tumores, Onuchic disse. Experimentos anteriores com os outros NEETs mostraram que a regulação negativa de sua expressão ou direcionamento de seus centros cortam a quantidade de energia disponível para as células cancerosas, o que reduz o crescimento do tumor.
"As células cancerosas precisam de muito mais ferro do que células saudáveis com homeostase normal de ferro, "disse ele." Quando uma célula se divide, tem que dobrar os ribossomos, e isso é energeticamente muito caro. Como as células cancerosas se dividem tão rapidamente, eles precisam de muito mais ferro e dependem do ciclo NEET para fornecê-lo.
"O câncer usa as três proteínas NEET porque elas requerem muito ferro e oxigênio reativo, "Onuchic disse." O que observamos - embora não esteja exatamente claro como eles funcionam - é que se você derrubar qualquer um deles, faz com que os tumores fiquem menores. Mesmo se você derrubar apenas um, reduz o crescimento do câncer. "Como a MiNT é uma produtora mais prodigiosa de ferro e ROS, pode ser o mais eficaz dos três para atingir, ele disse.
"A descoberta da estrutura MiNT, dinâmica e envolvimento no acúmulo de ferro mitocondrial e ROS permitiu a caracterização da família de proteínas humanas NEET completa, "disse a co-autora Rachel Nechushtai, professor da Universidade Hebraica de Jerusalém. "Além disso, Ele fornece à nossa equipe internacional a oportunidade única de desvendar as inter-relações das três proteínas NEET e descobrir em quais vias celulares elas estão envolvidas.
"A descoberta de que todas as três proteínas ferro-enxofre cooperam na mesma via para proteger as células cancerosas fornece um excelente conjunto de alvos para a terapia do câncer, " ela disse.
"A ligação que as proteínas NEET fornecem entre os níveis de ferro nas células cancerosas e o nível de espécies reativas de oxigênio demonstra como as células cancerosas controlam o equilíbrio entre uma alta taxa de proliferação e mutações, que é a chave para a nossa compreensão de como combater o câncer, "disse o co-autor Ron Mittler, professor de ciências biológicas da University of North Texas.