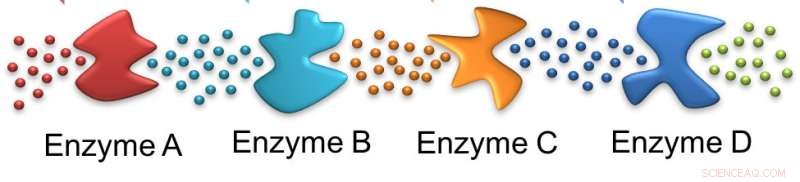
Como formigas, uma enzima segue a trilha deixada pela anterior. Nesse caso, o substrato inicial é influenciado pela enzima A, deixando um substrato adequado para a enzima B e assim por diante. Crédito:Ayusman Sen, Estado de Penn
Uma colher de açúcar pode fazer o remédio descer, mas entender o que acontece com esse açúcar na célula é muito mais complicado do que a simples digestão, de acordo com os pesquisadores. Para que os açúcares metabolizem e forneçam energia às células, uma série de enzimas - catalisadores biológicos - deve, cada uma, por sua vez, quebrar um reagente. Nesse caso, os pesquisadores usaram glicose, o açúcar encontrado no xarope de milho e um dos dois açúcares que resultam quando o açúcar de mesa - a sacarose - é decomposto no corpo.
Nesta cascata, a primeira enzima atua na glicose fornecida à célula e as enzimas subsequentes atuam em produtos sucessivos. No processo, duas moléculas de trifosfato de adenosina - ATP - são consumidas, mas quatro são produzidas. A hidrólise do ATP alimenta muitos processos celulares para manter a viabilidade da célula. Cascatas enzimáticas semelhantes são responsáveis por muitos processos metabólicos no corpo.
As enzimas que participam de tais vias de reação, em alguns casos, mostraram se formarem intracelulares, complexos reversíveis denominados metabolons por Paul Srere (falecido), University of Texas Southwestern Medical School. Ter as enzimas próximas umas das outras facilita a série de reações que elas catalisam. Um exemplo é o purinossomo descoberto no Professor da Universidade Evan Pugh e cadeira Eberly em Química Stephan J. Benkovic's Lab em Penn State, que consiste em seis enzimas envolvidas na biossíntese de purinas.
Os pesquisadores perguntaram se um dos fatores que contribuem para a formação do metabólon poderia ser um gradiente de substâncias químicas geradas pelas enzimas participantes. Eles relatam seus resultados na edição de hoje (18 de dezembro) da Química da Natureza .
"Descobrimos há algum tempo que moléculas de catalisador simples, como enzimas, também quimiotaxam o gradiente de um reagente, "disse Ayusman Sen, distinto professor de química, Estado de Penn. "Eles se movem em direção a concentrações cada vez mais altas de reagente."
O movimento é denominado quimiotaxia, onde moléculas individuais migram ao longo de um gradiente de concentração de outras moléculas.
"Todas as coisas vivas quimiotaxia, "disse o Sen." Se você está com fome e de repente sente o cheiro de batata frita, você tentará caminhar em direção às batatas fritas. Se o cheiro diminuir, você vai virar aleatoriamente para tentar encontrar a concentração mais alta de moléculas de odor de batata frita até chegar ao balcão de batata frita. "
Em seu estudo, os pesquisadores usaram apenas as primeiras quatro enzimas da via glicolítica - hexoquinase, fosfoglucose isomerase, fosfofrutocinase e aldolase. Essas quatro etapas realmente consomem ATP. Para estudar o movimento das enzimas, os pesquisadores usaram marcação fluorescente de hexoquinase e aldolase, a primeira e a quarta enzimas na via. Cada um foi marcado com um corante fluorescente diferente para que o movimento de ambas as enzimas pudesse ser seguido.
Eles examinaram três casos - a reação normal em que a hexoquinase fosforila a glicose; a reação de hexoquinase com manose, um açúcar que se liga mais fortemente, mas tem uma taxa de reação mais lenta; e finalmente com L-glicose, uma forma de glicose que não é usada pela hexoquinase. A fosforilação requer ATP. Na presença de fosfoglicose isomerase - a segunda enzima - e fosfofrutocinase - a terceira enzima - o reagente para a aldolase é produzido.
Os pesquisadores observaram que a aldolase se move em direção à hexoquinase em seu experimento de fluxo, revelando que a aldolase estava quimiotaxando o gradiente de reagente produzido pelo funcionamento das três primeiras enzimas na via. A quimiotaxia foi maior com D-glicose, menos com manose e não observado com L-glicose.
A modelagem teórica do movimento da enzima previu qualitativamente a extensão do movimento da enzima.
Os pesquisadores também analisaram se a quimiotaxia de enzimas ocorreria em um modelo de ambiente intracelular excepcionalmente lotado. Eles adicionaram uma substância de grande peso molecular para simular tal aglomeração. A quimiotaxia ainda ocorreu, mas em um ritmo mais lento.
"A quimiotaxia ao longo de um gradiente químico pode ser um fator na montagem de aglomerados de enzimas, como metabólons, "disse Benkovic." Outros fatores, como as interações não covalentes ainda deveriam contribuir. "
A resolução do instrumento de pesquisa, Contudo, foi insuficiente para demonstrar, neste caso, que as quatro enzimas estavam se reunindo em um metabólon. Os pesquisadores observaram a formação de grandes agregados de enzimas, mas não conseguiram demonstrar que eram metabólitos funcionando.