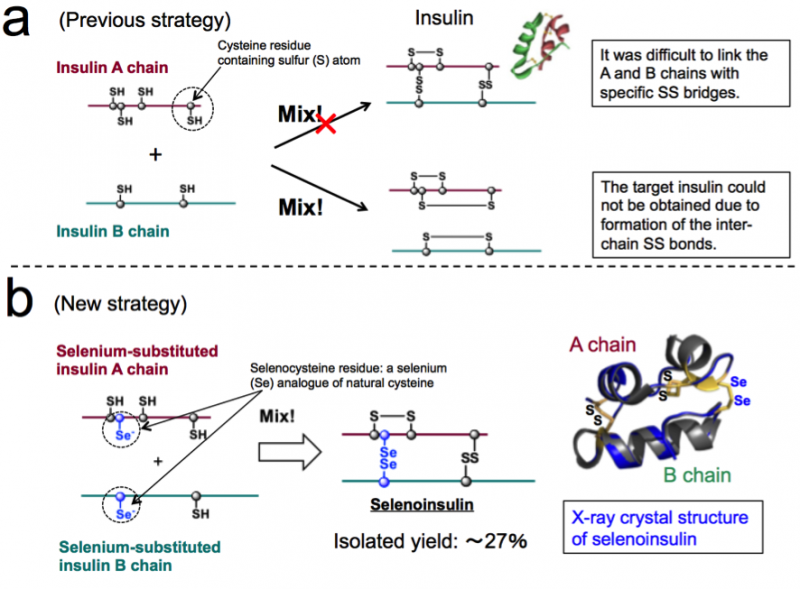
Figura 1. Síntese química de insulina. (a) Estratégia anterior baseada no acoplamento entre as cadeias A e B da insulina nativa. (b) Nova estratégia que explora a natureza única da selenocisteína e a estrutura cristalina de raios-X da selenoinsulina. (Esses números são citados do artigo original com modificações.). Crédito:Universidade de Osaka
Um grupo de pesquisadores desenvolveu análogos sintéticos da insulina selenoinsulina (Se-Ins) por meio da substituição do dissulfeto intercadeia na insulina pancreática bovina (BPIns) por uma ponte disseleneto.
Este grupo demonstrou que Se-Ins tinha uma estrutura quase idêntica e bioatividade comparável às dos BPins, e que tinha maior resistência à degradação do IDE. Isso é uma promessa para a aplicação de Se-Ins a uma preparação de insulina de longa duração na terapia do diabetes.
Depois de circular na corrente sanguínea, a insulina é degradada por uma enzima degradante da insulina (IDE) nos rins e excretada na urina. Esse grupo pensava que a produção de insulina com alta resistência à degradação por IDE levaria ao desenvolvimento de um novo tipo de preparações de insulina de longa duração que poderiam circular no corpo por muito tempo.
A insulina consiste em duas cadeias polipeptídicas:cadeia A e cadeia B, conectado por uma ligação dissulfeto (ligação Se-Se), portanto, é difícil tirar insulina apenas dessas cadeias por causa das ligações Se-Se. Assim, este grupo pensava que se as cadeias A e B da insulina contendo selênio (Se) em vez de enxofre (S), foram usados, a ligação disseleneto (ligação Se-Se) seria formada rapidamente e, em seguida, a reação de montagem em cadeia poderia ser realizada de forma eficiente, como Se é mais reativo do que S.
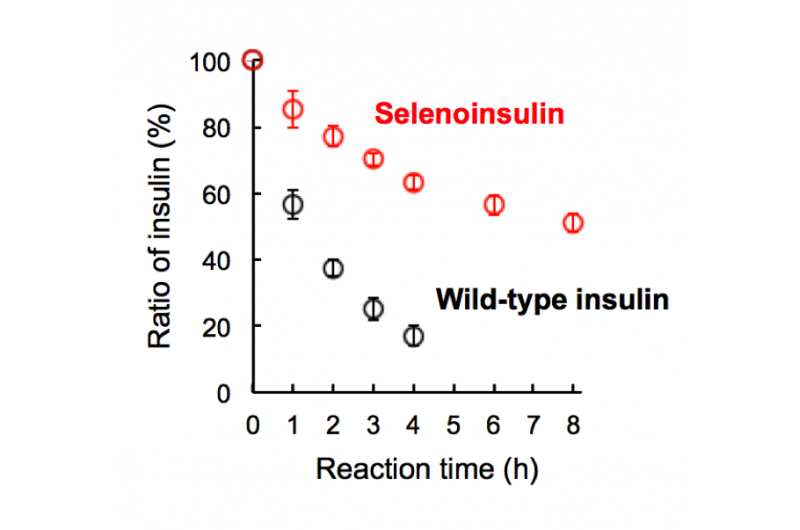
Figura 2. Degradação da selenoinsulina (vermelha) e da insulina do tipo selvagem (preta) pela enzima de degradação da insulina (IDE). (Esta figura foi citada do artigo original com pequenas modificações.). Crédito:Universidade de Osaka
Além disso, As ligações Se-Se são mais estáveis do que as ligações S-S, portanto, este grupo antecipou que as ligações Se-Se dariam robustez estrutural extra na dobra da insulina, resultando assim na maior resistência à degradação do IDE devido à sua estabilidade intrínseca. Com base neste conceito, este grupo teve sucesso na síntese de cadeias A e B de insulina contendo Se, bem como a obtenção de Se-Ins com rendimento de isolamento de até 27% pela reação de cadeias de peptídeos em condições ideais.
Este grupo demonstrou que Se-Ins tinha uma estrutura quase idêntica à dos BPIns, sugerindo que Se-Ins tem uma bioatividade comparável à dos BPIns. Experimentos de degradação de BPIns e Se-Ins usando IDE mostraram que a taxa de degradação de Se-Ins era muito mais lenta do que a de BPIns. A partir disso, acredita-se que os Se-Ins tenham uma natureza de longa duração e possam ser uma nova classe de análogos de insulina de longa ação para a terapia do diabetes.
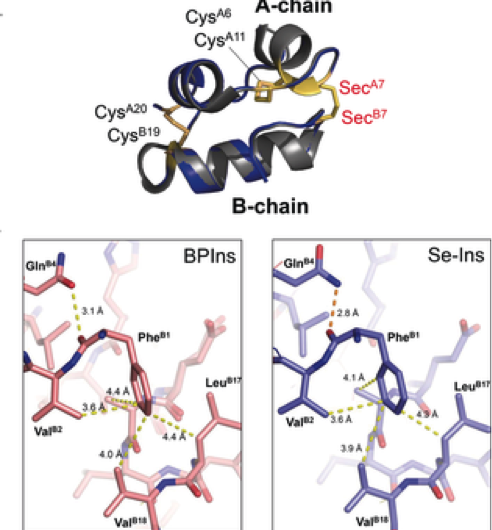
Figura 3. Preparação de selenoinsulina como um análogo de insulina de longa duração. Crédito:Universidade de Osaka