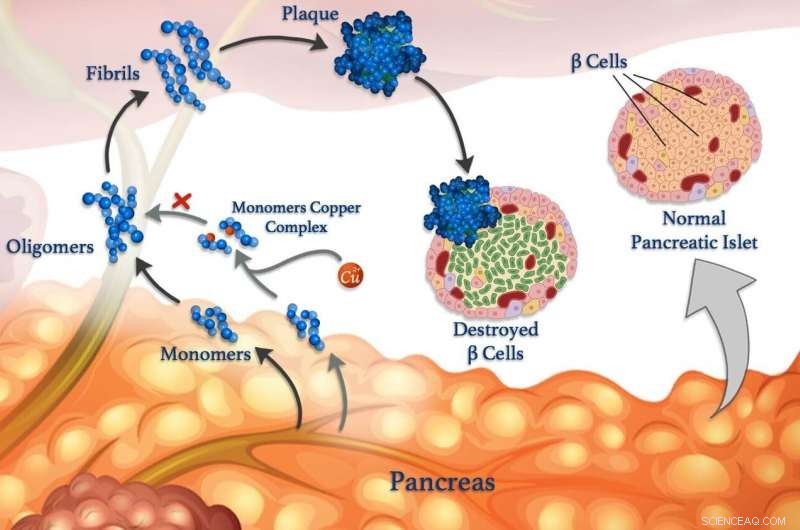
Os íons de cobre (esferas vermelhas) podem se ligar a monômeros de peptídeo (azul) e impedir que eles se aglutinem para formar oligômeros, fibrilas e placas prejudiciais. © 2020 Mawadda Alghrably
Desvendar as interações entre íons metálicos e peptídeos no corpo pode eventualmente levar a melhores tratamentos para o diabetes, Alzheimer e outras doenças. Compreender essas interações é o foco da pesquisa, co-liderado por KAUST, isso é revelador de como os metais, como cobre, pode afetar a formação de aglomerados prejudiciais de aglomerados de peptídeos mal dobrados chamados fibrilas, que sustentam muitas doenças.
Peptídeos errantes estão ligados a condições neurológicas, como Alzheimer, bem como diabetes, doenças de controle de açúcar no sangue. Os níveis de açúcar no sangue são normalmente controlados por hormônios peptídicos liberados por células especializadas chamadas células β. Bem como a insulina, as células β saudáveis também liberam amilina, um hormônio peptídico que ajuda a reduzir os picos no nível de açúcar no sangue após as refeições, diminuindo o esvaziamento do estômago. Mas a amilina é propensa a formar aglomerados mal dobrados, especialmente na presença de íons de cobre, que danificam as células β e contribuem para o diabetes tipo II.
Contudo, íons metálicos também podem neutralizar a agregação de peptídeos em algumas circunstâncias, diz o pesquisador KAUST, Mariusz Jaremko, que liderou o trabalho em colaboração com pesquisadores da Universidade de Wroclaw, na Polônia. Para estudar o processo com mais detalhes, a equipe está examinando a interação entre os íons de cobre (II) e a amilina e seus análogos moleculares. "Esse conhecimento nos daria insights sobre os mecanismos moleculares do diabetes tipo II, permitindo-nos conceber novas estratégias e terapias contra esta doença, "Jaremko diz.
Em seu último trabalho, a equipe estudou a influência dos íons de cobre na agregação de dois análogos da amilina humana:uma droga que imita a amilina chamada pramlintida e amilina de ratos. "Descobrimos que as diferenças nas estruturas de pramlintida e amilina de rato significam que os íons de cobre impedem a agregação de pramlintida, mas não amilina de rato, "diz Mawadda Alghrably, um Ph.D. aluno da equipe de Jaremko.
Os pesquisadores investigaram o processo usando várias técnicas, incluindo ressonância magnética nuclear (em colaboração com Abdul-Hamid Emwas da KAUST CoreLabs), e um ensaio de fluorescência de "tioflavina T" de agregação de proteínas. Eles descobriram que, embora ambos os análogos de amilina liguem cobre, O pramlintide pode ligá-lo de duas maneiras diferentes devido a um aminoácido histidina extra de ligação de cobre que está presente no pramlintide, mas não na amilina de rato. A ligação de íons de cobre a esta histidina provavelmente explicou porque o cobre reduziu a agregação de pramlintida, mas não a agregação de amilina de rato, concluíram os pesquisadores.
A equipe continua a decifrar a base molecular da agregação de amilina, Alghrably diz. "Entender como essas moléculas se comportam, poderia, em última análise, ajudar a facilitar a concepção de novos medicamentos e terapias eficientes para a diabetes tipo II, " ela diz.