Crédito:Katsutoshi Nagaoka
(Phys.org) —Hydrogen tem o potencial de fornecer uma alternativa, fonte de energia limpa, particularmente quando aplicado à tecnologia de células de combustível. As fontes de combustível atuais envolvem combustíveis fósseis contendo carbono ou moléculas orgânicas contendo carbono, que resultam na produção de excesso de CO 2 , um gás de efeito estufa. Diversas iniciativas, incluindo uma iniciativa nacional no Japão, procuram criar uma sociedade de baixo uso de carbono usando fontes alternativas de combustível.
A iniciativa Energy Carriers no Japão é um projeto nacional que está especificamente procurando maneiras de armazenar e transportar hidrogênio de maneira eficiente. Uma maneira de fazer isso é usar amônia como fonte de hidrogênio. Contudo, a descoberta de um processo eficiente para quebrar a amônia tem se mostrado difícil, em grande parte porque o processo catalítico para quebrar a amônia requer a adição contínua de calor, que pode ser proibitivamente caro.
Katsutoshi Nagaoka, Takaaki Eboshi, Yuma Takeishi, Ryo Tasaki, Kyoto Honda, Kazuya Imamura, e Katsutoshi Sato da Oita University no Japão desenvolveram um método usando um novo catalisador para a produção de hidrogênio a partir da amônia sem a adição de calor externo por meio do ciclo catalítico. O trabalho deles aparece em Avanços da Ciência .
A decomposição da amônia em hidrogênio e nitrogênio é um processo endotérmico, o que significa que requer a adição de energia para obter produtos. Isso significa que as reações de decomposição catalítica tradicionais requerem a adição de uma grande quantidade de calor para obter uma quantidade útil de gás hidrogênio.
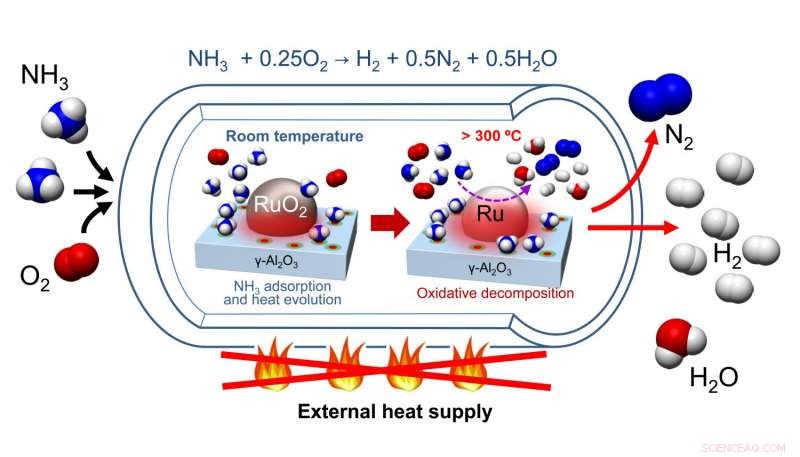
Nagaoka et al. desenvolveu um catalisador feito de RuO 2 nanopartícula com suporte em γ-Al 2 O 3 leito do catalisador. Depois de purgar seu catalisador de H 2 O e CO 2 , amônia e oxigênio foram adicionados ao vaso de reação, onde a amônia foi adsorvida na superfície catalítica, resultando em um aumento da temperatura. Este aumento na temperatura catalisou a decomposição oxidativa da amônia, um processo exotérmico. Isso aqueceu a reação, que por sua vez, forneceu a energia para a decomposição endotérmica da amônia em hidrogênio e nitrogênio.
O pré-tratamento do catalisador exigia aquecimento para remover água e dióxido de carbono, mas não exigiu reaquecimento subsequente. Os testes de ciclagem do catalisador mostraram que após o pré-tratamento inicial do RuO 2 / γ-Al 2 O 3 catalisador com hélio em 300 o C, o catalisador foi capaz de fazer três ciclos e ainda produzir hidrogênio com rendimentos máximos. Além disso, esses estudos incluíram passivação oxidativa para garantir que nenhum calor fosse produzido a partir da oxidação de Ru em RuO 2 . Na prática, a passivação oxidativa não será necessária. Então, mesmo que o aquecimento seja necessário para pré-tratar o catalisador, aquecimento não é necessário para ciclos adicionais do catalisador.
Em um esforço para entender como o RuO 2 / γ-Al 2 O 3 catalisador funciona, Nagaoka et al. comparou a temperatura máxima do leito catalítico que resulta do autoaquecimento de RuO 2 / γ-Al 2 O 3 para RuO 2 / La 2 O 3 , um conhecido catalisador de decomposição de amônia. Eles descobriram que o catalisador à base de alumínio aquecido a uma temperatura máxima de 97 o C, enquanto o catalisador à base de lantânio é aquecido a uma temperatura máxima de 53 o C. Isso é importante porque a temperatura de autoignição para a combustão oxidativa da amônia é 90 o C, e explica por que melhores rendimentos de reação foram vistos com RuO 2 / γ-Al 2 O 3 .
Os autores apontam que essa diferença na temperatura de adsorção é provavelmente devido à interação favorável entre a amônia, uma molécula básica, e Al 2 O 3 , que é um ácido de Lewis. La 2 O 3 , por outro lado, é uma base de Lewis.
Adicionalmente, os autores observaram a diferença entre o uso de γ-Al puro 2 O 3 como um catalisador e RuO 2 / γ-Al 2 O 3 . Eles descobriram que 90% da amônia adsorve em γ-Al2O3 nu em comparação com o leito de catalisador e o RuO 2 Nano-partícula. Isso implica que a amônia é quimicamente absorvida na nanopartícula e o γ-Al 2 O 3 , que então promove a fisiossorção multicamadas.
Geral, este tipo de catalisador é útil no fornecimento de calor suficiente para superar os requisitos de calor necessários para a decomposição endotérmica da amônia em hidrogênio e gás nitrogênio. Este estudo mostra que a catálise de autoaquecimento é uma opção viável para explorar soluções para as dificuldades práticas do uso da amônia como fonte de hidrogênio combustível.
© 2017 Phys.org