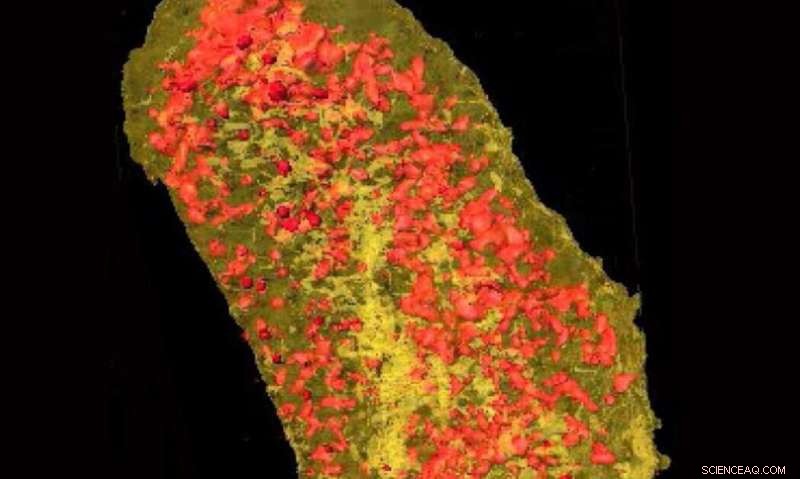
Radiografias ultrabright revelaram a concentração de érbio (amarelo) e zinco (vermelho) em uma única célula de E. coli expressando uma etiqueta de ligação a lantanídeos e incubada com érbio. Crédito:Laboratório Nacional de Brookhaven
Uma equipe de cientistas, incluindo pesquisadores do National Synchrotron Light Source II (NSLS-II) - um Departamento de Energia dos EUA (DOE) Office of Science User Facility no Brookhaven National Laboratory do DOE - demonstrou uma nova técnica para imagens de proteínas em 3-D com resolução em nanoescala. Trabalho deles, publicado no Jornal da American Chemical Society , permite que os pesquisadores identifiquem a localização precisa das proteínas dentro das células individuais, atingindo a resolução da membrana celular e as menores organelas subcelulares.
"No mundo da biologia estrutural, os cientistas usam técnicas como cristalografia de raios-X e microscopia crioeletrônica para aprender sobre a estrutura precisa das proteínas e inferir suas funções, mas não aprendemos onde eles funcionam em uma célula, "disse a autora correspondente e cientista do NSLS-II Lisa Miller." Se você estiver estudando uma doença específica, você precisa saber se uma proteína está funcionando no lugar errado ou não está funcionando. "
A nova técnica desenvolvida por Miller e seus colegas é semelhante em estilo aos métodos tradicionais de microscopia de fluorescência em biologia, em que uma molécula chamada proteína fluorescente verde (GFP) pode ser anexada a outras proteínas para revelar sua localização. Quando o GFP é exposto à luz ultravioleta ou visível, fluorescente em uma cor verde brilhante, iluminando uma proteína de outra forma "invisível" na célula.
"Usando GFP, podemos ver se uma proteína está em estruturas subcelulares com centenas de nanômetros de tamanho, como o núcleo ou o citoplasma, "Miller disse, "mas estruturas como uma membrana celular, que tem apenas sete a 10 nanômetros de tamanho, são difíceis de ver com tags de luz visível como GFP. Para ver estruturas do tamanho de 10 nanômetros em uma célula, você se beneficia muito com o uso de raios-X. "
Para superar este desafio, pesquisadores do NSLS-II se uniram a cientistas do Instituto de Tecnologia de Massachusetts (MIT) e da Universidade de Boston (BU), que desenvolveram uma marca sensível a raios-X chamada marca de ligação a lantanídeos (LBT). LBTs são proteínas muito pequenas que podem se ligar fortemente aos elementos da série dos lantanídeos, como érbio e európio.
"Ao contrário do GFP, que fica fluorescente quando exposta a UV ou luz visível, lantanídeos fluorescem na presença de raios-X, "disse a autora principal Tiffany Victor, um associado de pesquisa no NSLS-II. "E uma vez que os lantanídeos não ocorrem naturalmente na célula, quando os vemos com o microscópio de raios-X, sabemos a localização da nossa proteína de interesse. "
Os pesquisadores do NSLS-II, MIT, e BU trabalharam juntos para combinar a tecnologia LBT com fluorescência de raios-X.
"Embora os LBTs tenham sido usados extensivamente na última década, eles nunca foram usados para estudos de fluorescência de raios-X, "Disse Miller.
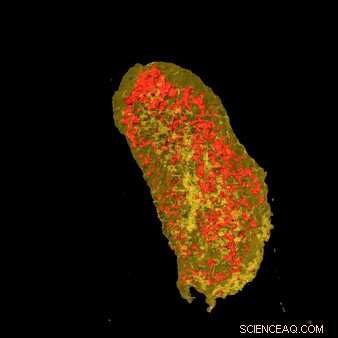
Radiografias ultrabright revelaram a concentração de érbio (amarelo) e zinco (vermelho) em uma única célula de E. coli expressando uma etiqueta de ligação a lantanídeos e incubada com érbio. Crédito:Laboratório Nacional de Brookhaven
Além de obter imagens de alta resolução, A fluorescência de raios-X fornece simultaneamente imagens químicas em todos os oligoelementos em uma célula, como o cálcio, potássio, ferro, cobre, e zinco. Em outros estudos, A equipe de Miller está pesquisando como oligoelementos como o cobre estão ligados à morte de neurônios em doenças como o mal de Alzheimer. Visualizar a localização desses elementos em relação a proteínas específicas será a chave para novas descobertas.
Além de sua compatibilidade com raios-X, LBTs também são benéficos por seu tamanho relativamente pequeno, em comparação com as etiquetas de luz visível.
"Imagine que você tivesse uma cauda presa a você do tamanho de todo o seu corpo, ou maior, "Miller disse." Haveria um monte de atividades normais que você não seria mais capaz de fazer. Mas se você só tivesse que andar por aí com um pequeno rabo de porco, você ainda pode correr, pular, e passar pelas portas. GFP é como a cauda grande - pode ser um verdadeiro impedimento para a função de muitas proteínas. Mas essas pequenas etiquetas de ligação de lantanídeos são quase invisíveis. "
Para demonstrar o uso de LBTs para imagens de proteínas em 3-D com resolução em nanoescala, os pesquisadores do MIT e BU marcaram duas proteínas em uma célula bacteriana - uma proteína citoplasmática e uma proteína de membrana. Então, A equipe de Miller estudou a amostra na linha de luz Hard X-ray Nanoprobe (HXN) no NSLS-II e na linha de luz Bionanoprobe na Advanced Photon Source (APS) - um DOE Office of Science User Facility no DOE's Argonne National Laboratory.
"A HXN oferece o tamanho de foco de raio-X líder mundial, que desce para cerca de 12 nanômetros. Isso foi fundamental para a imagem da célula bacteriana em 3-D com resolução em nanoescala, "disse Yong Chu, cientista-chefe da linha de luz na HXN. "Também desenvolvemos uma nova forma de montar as células em um porta-amostras especializado para otimizar a eficiência das medições."
Ao combinar a resolução incomparável de HXN com os recursos de LBTs, a equipe foi capaz de obter imagens de ambas as proteínas marcadas. A visualização da proteína da membrana celular provada LBTs pode ser vista em alta resolução, enquanto a imagem da proteína citoplasmática mostrou que os LBTs também podiam ser visualizados dentro da célula.
"Em altas concentrações, os lantanídeos são tóxicos para as células, "Victor disse, "então foi importante para nós mostrar que poderíamos tratar células com uma concentração de lantanídeos muito baixa que não era tóxica e substancial o suficiente para passar pela membrana celular e obter imagens das proteínas que queríamos ver."
Agora, com esta nova técnica demonstrada com sucesso, os cientistas esperam ser capazes de usar LBTs para obter imagens de outras proteínas dentro da célula com uma resolução de 10 nanômetros.