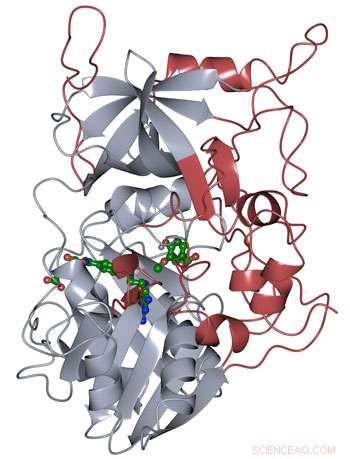
A estrutura da proteína de LigM foi determinada usando cristalografia de raios-X, revelando novos elementos estruturais que são únicos para LigM (vermelho), além de um domínio de ligação de tetraidrofolato conservado (cinza) que é encontrado ao longo da vida. LigM se liga a seus substratos (verde) usando cavidades de ligação internas. Crédito:Amanda Kohler / JBEI
Uma proteína usada por bactérias comuns do solo está fornecendo novas pistas no esforço de converter compostos de arila, um produto residual comum de práticas industriais e agrícolas, em algo de valor.
Pesquisadores do Laboratório Nacional Lawrence Berkeley do Departamento de Energia (Berkeley Lab) e Sandia National Laboratories que trabalham no Joint BioEnergy Institute (JBEI) resolveram a estrutura da proteína da enzima LigM, que é utilizado pela bactéria do solo Sphingomonas para metabolizar compostos aril derivados da lignina, o duro, material orgânico que dá estrutura às plantas.
Seu trabalho é relatado hoje no Proceedings of the National Academy of Sciences .
Na produção de biocombustíveis, os compostos arílicos são um subproduto da degradação da lignina. Muitas das vias que levam à degradação da lignina envolvem desmetilação, que muitas vezes é um precursor crítico para quaisquer etapas adicionais na modificação de compostos de arila derivados de lignina.
A autora principal do estudo, Amanda Kohler, Pesquisador de pós-doutorado do JBEI na Sandia, observou que LigM é uma desmetilase atraente para uso na conversão aromática porque é um simples, sistema de enzima única. LigM também é capaz de manter sua funcionalidade em uma ampla faixa de temperatura.
"Quando tentamos construir novos caminhos na biologia sintética, quanto mais simples o sistema, melhor, "disse Kohler.

A pesquisadora de pós-doutorado Amanda Kohler configura reações enzimáticas como parte do Grupo de Otimização de Enzimas do JBEI. Crédito:Marilyn Chung / Berkeley Lab
Os pesquisadores descobriram que metade da enzima LigM era homóloga a estruturas conhecidas com um domínio de ligação de tetrahidrofolato que é encontrado em organismos simples e complexos. A outra metade da estrutura do LigM é completamente única, fornecer um ponto de partida para determinar onde seu local de ligação ao substrato de aril está localizado. Eles também descobriram que LigM é uma desmetilase dependente de tirosina.
"É o primeiro de seu tipo a ser identificado, "disse Kohler." Esta pesquisa fornece a base necessária para ajudar no desenvolvimento de um sistema baseado em enzimas para converter resíduos aromáticos em algo útil. "
Kohler disse que agora está trabalhando na engenharia do LigM para que seja capaz de atuar em uma gama mais ampla de substratos de arila, além de visar produtos específicos de resíduos de arila.