 Os eucariontes basais Trichoplax adhaerens e Neurospora crassa abrigam GSDMs somente de domínio formador de poros que são ativados para causar morte celular através de mecanismos independentes de clivagem. Crédito:Ding Jingjin e outros
Os eucariontes basais Trichoplax adhaerens e Neurospora crassa abrigam GSDMs somente de domínio formador de poros que são ativados para causar morte celular através de mecanismos independentes de clivagem. Crédito:Ding Jingjin e outros A piroptose é um tipo de morte celular programada mediada pela família de proteínas gasdermina (GSDM), que desempenha papéis importantes na defesa do organismo contra infecções por patógenos, eliminação de células anormais ou prejudiciais e outros processos. GSDMs são uma classe evolutivamente conservada de proteínas formadoras de poros que são amplamente distribuídas entre várias bactérias, fungos, invertebrados e todos os vertebrados.
Os GSDMs normalmente têm uma estrutura de dois domínios autoinibida. A clivagem proteolítica parece ser um mecanismo universal para a ativação de todos os GSDMs. Não se sabe se existem outros mecanismos de ativação além da clivagem por protease para GSDMs.
Em um estudo publicado na Science , pesquisadores liderados pelo Prof. Ding Jingjin do Instituto de Biofísica da Academia Chinesa de Ciências e pelo Prof. Shao Feng do Instituto Nacional de Ciências Biológicas revelaram novos mecanismos para ativação independente de clivagem de dois tipos de proteínas GSDM de eucariotos inferiores.
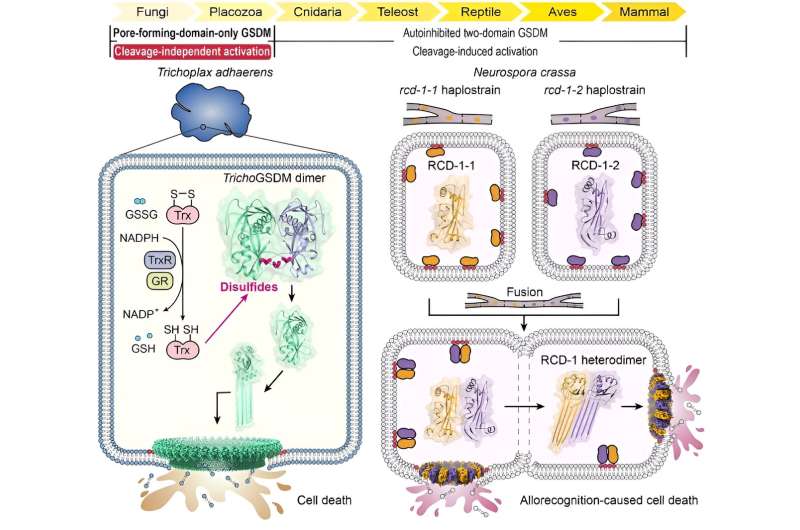
Através de extensa análise de homologia de sequência, os pesquisadores identificaram pela primeira vez uma proteína GSDM no metazoário basal Trichoplax adhaerens (TrichoGSDM) que contém apenas um domínio formador de poros. A caracterização do TrichoGSDM purificado revelou que esta proteína GSDM existe em dois estados:monómero e homodímero, tendo apenas a proteína monomérica a capacidade de formar poros nos lipossomas.
Análises estruturais e bioquímicas revelaram que o homodímero ligado por dissulfeto representa o estado autoinibitório do TrichoGSDM, que é ativado para o estado monomérico pela redução das ligações dissulfeto, oligomerizando ainda mais e formando poros na membrana celular para induzir morte celular semelhante à piroptose. Este novo mecanismo de ativação, descoberto no TrichoGSDM, é o primeiro desse tipo em toda a família GSDM.
Além disso, os pesquisadores se concentraram em outro tipo de proteína GSDM formadora de poros, chamada RCD-1, que foi recentemente identificada no fungo filamentoso Neurospora crassa. O RCD-1 contém duas proteínas homólogas, RCD-1-1 e RCD-1-2 em cepas diferentes, que regem a morte celular fúngica induzida por aloreconhecimento.
Eles descobriram que as proteínas RCD-1 ligadas à membrana existem num estado de repouso inativo quando deixadas sozinhas. No entanto, quando diferentes estirpes sofrem fusão celular, as duas proteínas RCD-1 encontram-se e montam-se num heterodímero através de reconhecimento intermolecular específico, formando ainda poros heterooligoméricos na membrana celular para executar morte celular semelhante à piroptose.
Neste estudo, TrichoGSDM e RCD-1 representam dois tipos de GSDMs somente de domínio formador de poros derivados de eucariotos simples e antigos que usam mecanismos de ativação independentes de clivagem distintos.
TrichoGSDM é um dímero autoinibido ligado por dissulfeto e é ativado pela redução dos dissulfetos, sugerindo uma função responsiva a redox. A atividade de formação de poros em RCD-1 é estimulada pelo hetero-reconhecimento entre RCD-1-1 e RCD-1-2 de cepas fúngicas geneticamente incomparáveis, subjacentes à morte celular induzida por aloreconhecimento em N. crassa.
Os diversos mecanismos de ativação sugerem que as proteínas GSDM podem responder a uma ampla gama de sinais fisiológicos e participar em múltiplos processos biológicos. Além disso, estas proteínas GSDM formadoras de poros têm o potencial de serem desenvolvidas como novas ferramentas para induzir a morte celular independente da clivagem da protease, facilitando a investigação básica e translacional relacionada com a piroptose.
