Projetando um novo substrato para diferenciação miogênica de células-tronco pluripotentes induzidas
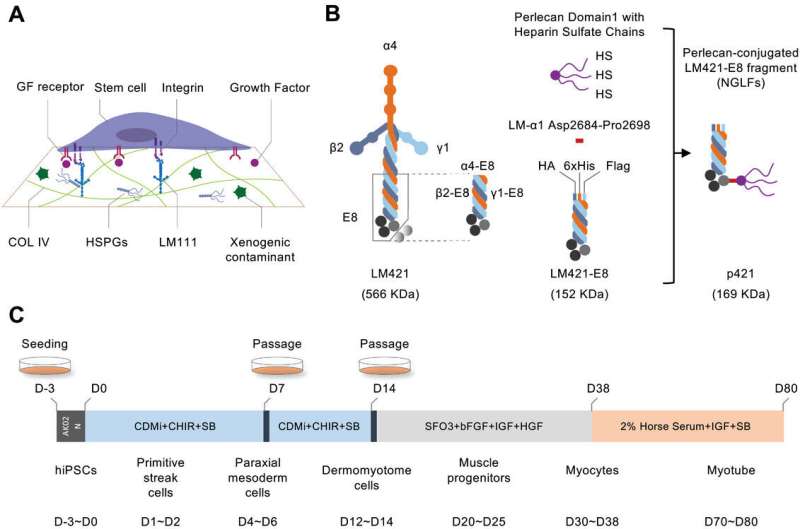 Triagem de NGLFs para otimizar a indução de miócitos de hiPSCs. a) Representações esquemáticas do crescimento de células-tronco em MG. b) Representações esquemáticas de LM421, LM421-E8 e p421. c) Representação esquemática da indução e diferenciação gradual do músculo esquelético de hiPSCs cultivadas em Stemfit (AK02N) durante três dias. d) Quantificação da % de área coberta por miócito (MHC+) após 38 dias de diferenciação. e) Coloração MHC, MYOD1 e DAPI de miócitos derivados da linha hiPSC MYF5-Tdtomato. f) Imagens representativas de tdTomato de células MYF5-tdTomato vivas e miotubos no dia 80 de diferenciação. g) Avaliação citométrica de fluxo da população de células MYF5+ aos 80 dias de diferenciação. Crédito:Ciência Avançada (2024). DOI:10.1002/advs.202308306
Triagem de NGLFs para otimizar a indução de miócitos de hiPSCs. a) Representações esquemáticas do crescimento de células-tronco em MG. b) Representações esquemáticas de LM421, LM421-E8 e p421. c) Representação esquemática da indução e diferenciação gradual do músculo esquelético de hiPSCs cultivadas em Stemfit (AK02N) durante três dias. d) Quantificação da % de área coberta por miócito (MHC+) após 38 dias de diferenciação. e) Coloração MHC, MYOD1 e DAPI de miócitos derivados da linha hiPSC MYF5-Tdtomato. f) Imagens representativas de tdTomato de células MYF5-tdTomato vivas e miotubos no dia 80 de diferenciação. g) Avaliação citométrica de fluxo da população de células MYF5+ aos 80 dias de diferenciação. Crédito:Ciência Avançada (2024). DOI:10.1002/advs.202308306 Desde a sua descoberta, os investigadores demonstraram repetidamente as potenciais aplicações médicas de células e tecidos diferenciados gerados a partir de células estaminais pluripotentes induzidas (iPS). No entanto, um obstáculo significativo para aplicações médicas no mundo real está relacionado ao substrato usado para cultivar e induzir células iPS em tipos de células diferenciados.
Em particular, embora tenham sido relatados protocolos de diferenciação que geram miócitos e células-tronco musculares (MuSCs) a partir de células iPS, eles permanecem com eficiência relativamente baixa e exigem o uso de um substrato popular de origem animal chamado Matrigel.
Seguindo em frente, são necessários protocolos de indução mais eficientes e uma mudança em direção a substratos livres de xeno (sem produtos de origem animal) capazes de garantir relação custo-benefício, reprodutibilidade e segurança.
Para este fim, uma equipe colaborativa do Japão combinou seus conhecimentos para projetar e validar uma nova proteína de matriz extracelular recombinante, denominada fragmentos de laminina de nova geração (NGLFs), para diferenciar células iPS em linhagens de células musculares.
Os resultados deste estudo foram publicados na Advanced Science em 29 de abril de 2024.
Estudos anteriores estabeleceram fragmentos de laminina E8 recombinante (LM-E8) como substrato mínimo para culturas de células iPS, mas não suportam diferenciação miogênica. Para identificar uma variante LM-E8 capaz de suportar a geração de miócitos e MuSC a partir de células iPS, a equipe testou várias lamininas com composições diferentes, mas descobriu que suportavam apenas níveis drasticamente mais baixos de diferenciação miogênica.
Os pesquisadores raciocinaram que o perlecan, um núcleo multifuncional de proteoglicano de heparan sulfato (HSPG) com múltiplas cadeias de heparan sulfato em Matrigel, pode ser vital para sua capacidade de suportar várias interações moleculares necessárias para a manutenção e diferenciação ideal de células iPS e, portanto, projetaram um LM-E8 anexado ao domínio perlecan 1 com três cadeias HS (D1-HS).
Os pesquisadores observaram melhorias significativas na diferenciação miogênica ao anexar esta modificação aos terminais C das variantes LM-E8. Em particular, a isoforma p421 apresentou a melhor melhoria, ainda melhor que a Matrigel, por isso os investigadores concentraram-se na utilização desta isoforma para gerar miócitos e MuSCs.
Ao examinar marcadores de diferenciação em vários estágios (ou seja, linha primitiva (PS), mesoderme paraxial (PM) e dermomiótomo (DM)), a equipe de pesquisa confirmou que não apenas os NGLFs são superiores às variantes correspondentes de LM-E8 na promoção de estágios específicos expressão do gene marcador, p421 suporta consistentemente uma melhor diferenciação do que qualquer outro NGLF testado.
Notavelmente, os pesquisadores descobriram que o p421 apoia especificamente a diferenciação para o estágio PM, já que nenhum efeito benéfico foi observado no p421 após a formação do PM. Além disso, usando heparitinase (para degradar as cadeias de HS) e surfen (para inibir as interações mediadas por HS), eles deduziram que os efeitos benéficos do p421 derivam principalmente da porção HS.
Além disso, ao bloquear múltiplos receptores de sinalização e seus efetores intracelulares a jusante, eles determinaram que o p421 funciona principalmente através da via bFGF-FGFR-EGF para promover a indução de PM. A análise da expressão gênica indicou ainda que esta sinalização apoiava a expressão do gene HOX para promover células iPS indiferenciadas em direção ao estágio PS.
Para demonstrar a importância da orientação de conjugação entre LM-E8 e D1-HS, os pesquisadores geraram variantes de p421 anexando a porção HS à extremidade N-terminal da cadeia β ou γ de LM-E8. Embora estas variantes aumentassem a expressão genética do marcador específico do estágio, o p421 mostrou efeitos substancialmente mais fortes em comparação.
A partir dessas descobertas, a equipe de pesquisa concluiu que o p421 provavelmente ajuda na sinalização do FGFR, aproximando os FGFs ligados ao HS da superfície celular para promover a dimerização do FGFR.
Finalmente, para ilustrar como o p421 melhora a diferenciação miogênica e supera as inconsistências que assolam os protocolos de indução atuais, a equipe de pesquisa gerou doenças e controlou linhas de células iPS para duas formas de distrofia muscular, distrofia muscular de Duchene (DMD) e miopatia de Miyoshi (MM).
Como esperado, o p421 apoiou uma diferenciação miogênica muito melhorada de todas as linhas celulares iPS examinadas. Além disso, os pesquisadores descobriram que o p421 melhorou a diferenciação miogênica em vários meios de cultura comumente usados.
Em resumo, a equipe de pesquisa criou com sucesso um substrato de proteoglicano recombinante que suporta melhorias significativas na diferenciação miogênica e demonstrou seu mecanismo subjacente.
Espera-se que os NGLFs ajudem a estabelecer protocolos de diferenciação altamente eficientes e livres de xeno para gerar linhagens de células musculares derivadas de células iPS para aplicações médicas contra várias miopatias.
