Novo estudo descobre pequeno alvo no RNA para causar curto-circuito na inflamação
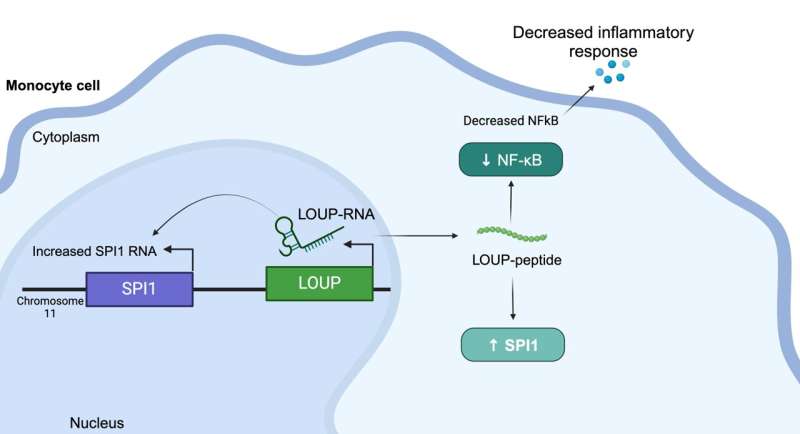 Pesquisadores da UC Santa Cruz descobriram que LOUP é um gene multifuncional em células do sistema imunológico chamadas monócitos. LOUP pode trabalhar dentro do núcleo para controlar seu vizinho SPI1. Eles também descobriram que o RNA LOUP pode deixar o núcleo e produzir um pequeno peptídeo no citoplasma, levando a um aumento na proteína SPI1 e causando uma regulação negativa do NF-kB, o controlador mestre da inflamação. Crédito:Carpenter Lab, UC Santa Cruz
Pesquisadores da UC Santa Cruz descobriram que LOUP é um gene multifuncional em células do sistema imunológico chamadas monócitos. LOUP pode trabalhar dentro do núcleo para controlar seu vizinho SPI1. Eles também descobriram que o RNA LOUP pode deixar o núcleo e produzir um pequeno peptídeo no citoplasma, levando a um aumento na proteína SPI1 e causando uma regulação negativa do NF-kB, o controlador mestre da inflamação. Crédito:Carpenter Lab, UC Santa Cruz Pesquisadores da UC Santa Cruz descobriram um peptídeo no RNA humano que regula a inflamação e pode fornecer um novo caminho para o tratamento de doenças como artrite e lúpus. A equipe usou um processo de triagem baseado na poderosa ferramenta de edição genética CRISPR para esclarecer um dos maiores mistérios sobre o nosso RNA – a molécula responsável por realizar a informação genética contida no nosso DNA.
Este peptídeo se origina de um longo RNA não codificante (lncRNA) chamado LOUP. Segundo os pesquisadores, o genoma humano codifica mais de 20 mil lncRNAs, o que o torna o maior grupo de genes produzidos a partir do genoma. Mas, apesar dessa abundância, os cientistas sabem pouco sobre por que existem os lncRNAs ou o que eles fazem. É por isso que o lncRNA é às vezes chamado de “matéria escura do genoma”.
O estudo, publicado em 23 de maio no Proceedings of the National Academy of Sciences (PNAS), é um dos poucos na literatura existente a desvendar os mistérios do lncRNA. Também apresenta uma nova estratégia para conduzir triagem de alto rendimento para identificar rapidamente lncRNAs funcionais em células do sistema imunológico. A abordagem de tela agrupada permite que os pesquisadores atinjam milhares de genes em um único experimento, o que é uma maneira muito mais eficiente de estudar porções não caracterizadas do genoma do que os experimentos tradicionais que se concentram em um gene de cada vez.
A pesquisa foi liderada pela imunologista Susan Carpenter, professora e presidente Sinsheimer do Departamento de Biologia Molecular, Celular e do Desenvolvimento da UC Santa Cruz. Ela estuda os mecanismos moleculares envolvidos na proteção contra infecções. Especificamente, ela se concentra nos processos que levam à inflamação para determinar o papel que os lncRNAs desempenham nessas vias.
“A inflamação é uma característica central de quase todas as doenças”, disse ela. “Neste estudo, meu laboratório se concentrou em tentar determinar quais genes de lncRNA estão envolvidos na regulação da inflamação”.
Isso significou estudar lncRNAs em um tipo de glóbulo branco conhecido como monócito. Eles usaram uma modificação da tecnologia CRISPR/Cas9, chamada inibição CRISPR (CRISPRi), para reprimir a transcrição genética e descobrir quais dos lncRNAs de um monócito desempenham um papel na diferenciação em macrófago – outro tipo de glóbulo branco que é crítico para uma resposta imunológica que funcione bem.
Além disso, os pesquisadores usaram o CRISPRi para rastrear lncRNA de macrófagos quanto ao envolvimento na inflamação. Inesperadamente, eles localizaram uma região que é multifuncional e pode funcionar como um RNA, além de conter um peptídeo desconhecido que regula a inflamação.
A compreensão de que este peptídeo específico regula a inflamação dá aos fabricantes de medicamentos um alvo para bloquear a interação molecular por trás dessa resposta, a fim de suprimi-la, disse Carpenter. “Em um mundo ideal, você projetaria uma pequena molécula para interromper essa interação específica, em vez de, digamos, ter como alvo uma proteína que poderia ser expressa em todo o corpo”, explicou ela. “Ainda estamos muito longe de atingir essas vias com esse nível de precisão, mas esse é definitivamente o objetivo. Há muito interesse na terapêutica do RNA no momento”.
Os co-autores do estudo da UC Santa Cruz incluem Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek e Sol Katzman, juntamente com pesquisadores da UCSF e do MIT.
