Como os parasitas mortais escolhem ser do sexo masculino:pesquisadores revelam a expressão genética ao longo do ciclo de vida do Cryptosporidium
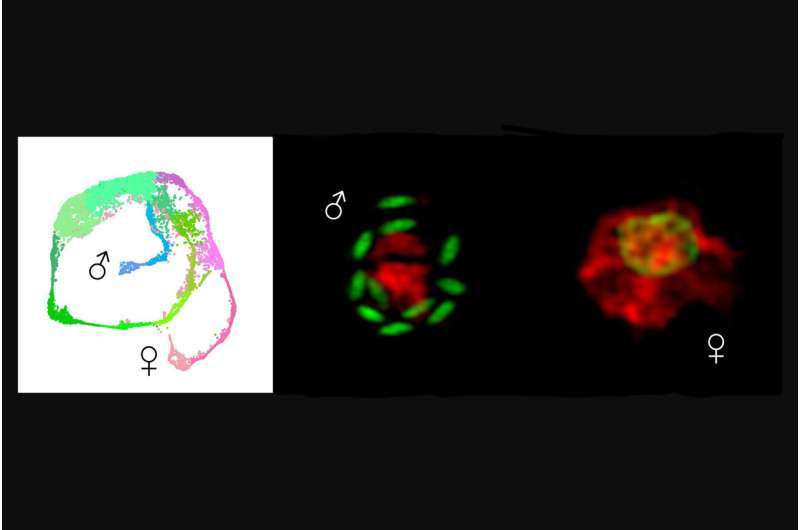 Pesquisadores da Penn Vet desenvolveram o atlas unicelular do Cryptosporidium, revelando quais genes são expressos em quais pontos do ciclo de vida do parasita. À esquerda, o atlas mostra parasitas replicando-se assexuadamente em verde, com machos em azul e fêmeas em rosa. À direita são mostradas micrografias dos estágios, com seus núcleos destacados em verde. Crédito:Boris Striepen
Pesquisadores da Penn Vet desenvolveram o atlas unicelular do Cryptosporidium, revelando quais genes são expressos em quais pontos do ciclo de vida do parasita. À esquerda, o atlas mostra parasitas replicando-se assexuadamente em verde, com machos em azul e fêmeas em rosa. À direita são mostradas micrografias dos estágios, com seus núcleos destacados em verde. Crédito:Boris Striepen O parasita unicelular Cryptosporidium é uma das principais causas de doenças diarreicas mortais em crianças pequenas, e um surto recente no Reino Unido realça o quão vulnerável é o abastecimento de água a este agente patogénico.
Não existem medicamentos ou vacinas eficazes, o que torna este organismo importante para estudar. O parasita infecta as células que revestem os intestinos e participa na replicação assexuada e sexual, que os investigadores suspeitam serem críticas para a infecção e transmissão sustentadas.
Mas o mecanismo pelo qual o parasita se torna macho ou fêmea é desconhecido. “Esses parasitas não têm cromossomos sexuais, como o X ou Y humano”, diz Katelyn A. Walzer, pós-doutoranda no Laboratório Striepen da Escola de Medicina Veterinária da Pensilvânia. “Revelar como escolhem o sexo é de interesse biológico fundamental e fornece um novo alvo-chave para bloquear a transmissão e a infecção”.
Walzer é o autor principal de um estudo publicado na Nature , que revela o programa de expressão gênica de todo o ciclo de vida do Cryptosporidium.
Usando sequenciamento de RNA, os pesquisadores traçaram o perfil de mais de 9.000 parasitas – de culturas de células infectadas e camundongos – e desenvolveram o atlas unicelular do Cryptosporidium, que revela quais genes são expressos em quais pontos do ciclo de vida.
Numa segunda descoberta importante, os investigadores identificaram o primeiro determinante da masculinidade, um gene chamado Myb-M.
“Mostramos neste e em outros trabalhos que a parte sexual deste ciclo de vida é crítica para a infecção, e bloqueá-la através de contracepção parasitária irá bloquear a infecção”, diz o autor sênior Boris Striepen. Ele diz que, ao interromper o sexo, “podemos ser capazes de curar a doença ou enfraquecer o parasita para desenvolver uma vacina, por isso penso que há um potencial de tradução muito forte”.
Isto baseia-se em pesquisas anteriores que revisaram o ciclo de vida para um ciclo de vida com apenas três estágios – uma única forma assexuada, machos e fêmeas – enquanto a literatura predominante propunha um estágio intermediário adicional.
Walzer explica que o Cryptosporidium infecta as pessoas, muitas vezes através de água contaminada, numa forma semelhante a um esporo chamada oocisto, que é resistente à cloração da água. Uma vez no intestino, os parasitas emergem dos esporos para invadir as células epiteliais que revestem o intestino e se replicam dentro dessas células antes de saírem e invadirem novas células intestinais.
Este ciclo assexuado de invasão, replicação e saída ocorre três vezes antes dos parasitas se diferenciarem em gametas masculinos e femininos, e então a fertilização leva a novos oocistos.
Walzer diz que, através desta nova investigação, “temos uma compreensão completa de todos os genes que estão envolvidos em cada um desses processos, desde a invasão ao crescimento, à divisão e depois à formação da forma invasiva novamente”.
Ela diz que este atlas oferece um plano detalhado de cada aspecto da biologia do parasita e suas vulnerabilidades potenciais. O Cryptosporidium produz muitas proteínas necessárias para invadir e manipular o hospedeiro, e o trabalho da equipe analisa essas diferentes proteínas com base no tempo em que seus genes são lidos.
“As formas invasivas do parasita vêm com uma bateria de armas que lhes permite invadir e ultrapassar as nossas células, e este arsenal é montado com notável precisão de tempo”, diz Striepen. Ele compara isso a uma linha de montagem de uma fábrica de automóveis onde novos componentes são fabricados na hora certa, e Walzer desenvolveu uma lista de todas as peças e quando elas são montadas.
Walzer diz que os pesquisadores nesta área estão entusiasmados com o atlas unicelular do Cryptosporidium porque podem pesquisar o contexto em que os genes que estão estudando são expressos. Esta é uma informação muito útil para quem procura alvos de medicamentos e vacinas, pois ajuda a prever as fases da infecção em que o parasita pode ser mais vulnerável.
Ao manipular parasitas para expressarem fluorescência, os investigadores também chegaram à sua segunda descoberta chave:a descoberta do factor de transcrição, ou seja, uma proteína que regula a expressão genética, responsável pela masculinidade, Myb-M.
“Quando forçamos o parasita a produzir esse fator em qualquer ponto, todo e qualquer parasita se tornou macho, e quando o retiramos nenhum macho se desenvolveu. É importante ressaltar que ambas as manipulações bloquearam a infecção”, diz Walzer.
Striepen diz que esta descoberta sublinha o valor do sexo parasita como alvo de intervenção, e Walzer diz que este estudo também "nos leva a conhecer o catálogo completo de genes necessários para o sexo parasita, fornecendo pistas importantes sobre o mecanismo e os alvos translacionais".
Walzer diz que em pesquisas futuras ela está interessada em acompanhar como Myb-M impulsiona o destino masculino e em compreender de forma mais geral como a regulação da transcrição impulsiona diferenças específicas de estágio para orquestrar o complexo ciclo de vida.
