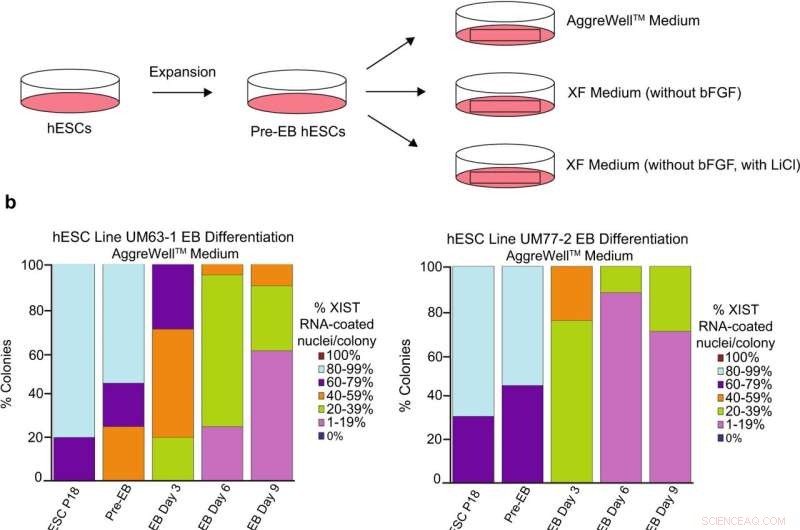
Análise do revestimento de RNA XIST durante a diferenciação de hESCs femininas. a Esquema de diferenciação de hESC em corpos embrióides (EBs) com três formulações de meios diferentes:um AggreWell comercialmente disponível
TM
médio; meio XF sem bFGF; e meio XF sem bFGF mas contendo 0,98 mM de LiCl. b Porcentagem de núcleos com revestimento de RNA XIST em EBs gerados a partir das linhas hESC UM77-2 e UM63-1. EBs gerados e cultivados em meio XF com LiCl e AggreWell
TM
O meio perdeu uma proporção significativa de revestimento de RNA XIST por colônia em comparação com EBs gerados e cultivados em meio XF (comparação de modelo linear geral; p < 0,001). Pelo menos 100 núcleos foram contados por colônia para quantificação de hESC RNA FISH. O número total de colônias quantificadas em cada passagem varia entre 10 e 17 e estão catalogadas nos dados de origem. Os dados de origem são fornecidos como um arquivo de dados de origem. Crédito:Comunicação da Natureza (2022). DOI:10.1038/s41467-022-30259-x
Na maioria dos mamíferos, as fêmeas têm dois cromossomos X e os machos têm um cromossomo X e um Y em cada uma de suas células. Para evitar uma dose dupla de genes ligados ao X nas fêmeas, um dos Xs é silenciado no início do processo de desenvolvimento. Esse silenciamento é crítico, mas como isso acontece tem sido relativamente misterioso. Dois novos estudos da U-M revelam mais sobre esse processo de silenciamento e insights que podem melhorar a pesquisa com células-tronco.
Células-tronco embrionárias humanas (hESCs) são uma enorme promessa para pesquisas sobre o desenvolvimento inicial, bem como para medicina regenerativa para doenças que variam de diabetes tipo 1 à doença de Parkinson. No entanto, os biólogos que trabalham com hESCs femininas no laboratório muitas vezes se deparam com um fenômeno em que o cromossomo X normalmente inativado perde essa supressão enquanto cresce em um prato de cultura.
"Se você não pode manter hESCs exatamente como tal na cultura, então você não pode usá-los para qualquer aplicação a jusante", disse Sundeep Kalantry, Ph.D., professor associado de genética humana. Ele, junto com Marissa Cloutier, Ph.D. trainee e sua equipe decidiram determinar por que a inativação do X se desgasta sob certas condições experimentais ao longo do tempo.
Seu principal suspeito era a substância usada para cultivar as células em cultura, chamada mídia. As células são cultivadas em meios que lhes fornecem instruções químicas chamadas fatores de crescimento. Esses fatores de crescimento sinalizam para as células-tronco continuarem se dividindo. Um meio popular, chamado mTeSR1, parecia estar correlacionado com a perda de um regulador chave da inativação do X, uma fita não codificante de RNA chamada XIST. Outro meio, chamado Xenofree, não levou à perda da inativação do X.
"Analisamos as diferenças na composição desses dois meios e identificamos o cloreto de lítio como presente no mTeSR1, mas não no Xenofree", disse Cloutier.
O cloreto de lítio às vezes é incluído na mídia para promover a proliferação de células-tronco, no entanto, sabe-se que interfere em muitas vias de sinalização celular ao inibir as proteínas GSK-3. (Inibidores das proteínas GSK-3 têm sido usados para tratar várias doenças, e o lítio, usado para tratar transtorno bipolar, foi um dos primeiros inibidores naturais de GSK-3 descobertos.)
Para confirmar o cloreto de lítio como o culpado, eles adicionaram o composto ao meio Xenofree e observaram uma perda de inativação do X. Seu artigo é publicado em
Nature Communications .
"Em termos gerais de nossa compreensão da inativação do X, nosso estudo fornece um possível novo modelo para a regulação desse processo", diz Cloutier. Kalantry acrescenta que seu estudo sugere que os pesquisadores precisam ser um pouco mais cautelosos com o uso de inibidores de GSK-3, como o lítio. “Eles podem não apenas interferir na inativação do X, mas em outros modos de regulação epigenética da transcrição em todo o genoma”.
Papel de um antigo gene ligado ao X na indução da inativação do X Um artigo separado, também publicado em
Nature Communications por Kalantry e colegas, fornece insights sobre a evolução da inativação do X em mamíferos. A premissa do estudo era que a inativação do X é desencadeada por um ou mais de um subconjunto de genes ligados ao X que paradoxalmente escapam da inativação do X uma vez que a inativação do X começou. Esses genes são expressos em ambos os cromossomos X em mulheres versus um único X em homens e, como resultado, são mais altamente expressos em mulheres versus homens. O laboratório de Kalantry, em estreita colaboração com o laboratório de Shigeki Iwase, também na Universidade de Michigan, descobriu que, devido à maior expressão em mulheres versus homens de um desses genes ligados ao X, Kdm5c, induz o Xist e, portanto, a inativação do X seletivamente em mulheres .
A exclusão de Kdm5c em ambos os cromossomos X em uma célula feminina desativou a inativação X quase completamente. Por outro lado, quando os pesquisadores introduziram o Kdm5c em células de camundongos machos, eles iniciaram com sucesso a inativação do X, que em circunstâncias normais não ocorreria.
Kdm5c é um gene ancestral ligado ao X que é compartilhado por todas as espécies de mamíferos. Os autores testaram e descobriram que Kdm5c de linhagens de mamíferos marsupiais e monotremados evolutivamente distantes (por exemplo, o ornitorrinco que põe ovos), que se separaram de mamíferos placentários há mais de 150 milhões de anos, também poderiam induzir notavelmente a inativação de Xist e X em células de camundongos machos. . Esta descoberta sugere que Kdm5c manteve uma função ancestral para induzir Xist e X-inativação em camundongos e humanos.
"Se expressar genes ligados ao X em níveis acima do normal em uma célula feminina, essa célula muitas vezes sofrerá e morrerá. Nos homens, se você reduzir a expressão de genes ligados ao X além dos níveis normais, inativando esse único X, o as células também sofrem e morrem", disse Kalantry. "O nível adequado de genes do cromossomo X é muito, muito importante para a saúde da célula."
A equipe espera explicar a seguir o processo aleatório que determina qual X em uma célula feminina é silenciado:o da mãe ou o do pai. Determinar esse mecanismo básico, diz Kalantry, poderia no futuro ser aplicado para reativar genes ligados ao X à vontade para fins terapêuticos potenciais.
