Ilustração. Prata. Crédito:@ tsarcyanide / MIPT
Pesquisadores do Instituto de Física e Tecnologia de Moscou se uniram a colegas da Rússia e da Arábia Saudita e propuseram um método eficiente para obter dados fundamentais necessários para a compreensão de processos químicos e físicos envolvendo substâncias no estado gasoso. O protocolo numérico proposto prevê o efeito térmico da formação em fase gasosa de compostos de prata e sua entropia absoluta. Isso inclui dados inéditos para mais de 90 compostos. Publicado no jornal Química Inorgânica , as descobertas são importantes para aplicações práticas de substâncias contendo prata, inclusive em água e desinfecção de feridas, fotografia e semeadura de nuvens.
A equipe derivou os valores precisos da entalpia de formação e da entropia de vários compostos de prata. A entalpia (do grego "thalpein, "significando" aquecer ") de um sistema descreve seu estado em termos da energia das partículas constituintes, pressão e volume. De acordo com a lei de Hess, multiplicar os coeficientes estequiométricos e a diferença entre as entalpias de formação dos reagentes e dos produtos resulta na quantidade de calor gerado ou consumido em uma reação química. Entropia é uma medida de quão desordenado é um sistema. A segunda lei da termodinâmica afirma que um sistema pode adotar espontaneamente um estado menos organizado, então a entropia aumenta com o tempo.
Conhecer os valores de entalpia e entropia é crucial para prever se uma reação ocorrerá em determinadas condições. Essas características também indicam como o rendimento e a seletividade da reação - a razão entre os produtos - variam com a temperatura e a pressão, permitindo a otimização. As descobertas permitem aos pesquisadores fazer previsões sobre os processos químicos que ocorrem na fase gasosa. Os dados também ajudarão a gerenciar os processos envolvidos em filme fino e deposição de amostra pura da fase gasosa.
Existem basicamente duas maneiras de determinar as mudanças de entalpia e entropia - seja por meio de experimentos complexos e caros, ou usando os dados de livros de referência e fazendo alguma aritmética com base na lei de Hess.
"A escolha parece ser óbvia, mais ainda, considerando que você não pode medir experimentalmente o calor de algumas reações, "disse Yury Minenkov, pesquisador sênior do Laboratório de Métodos de Supercomputação em Física da Matéria Condensada. "Por exemplo, a combustão incompleta de grafite sempre produz monóxido de carbono e dióxido de carbono. Portanto, mesmo medindo o efeito térmico da reação, não pudemos determinar a entalpia de formação de monóxido de carbono.
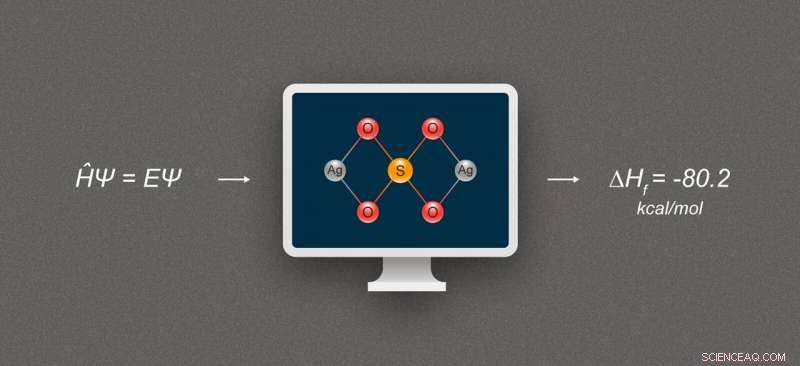
Figura 1. Diagrama simplificado que ilustra o cálculo da entalpia de formação para compostos de prata. O composto representado é o sulfato de prata, Ag₂SO₄. Crédito:@ tsarcyanide / MIPT
"Mas a abordagem computacional enfrenta alguns problemas, "Minenkov continuou." Primeiro, as entalpias de formação e entropias não são conhecidas para todos os compostos. Segundo, mesmo se os dados estiverem disponíveis, ninguém pode garantir sua precisão. Os valores variam amplamente entre os livros de referência. Às vezes, os erros de medição podem ser bastante grandes. "
Felizmente, a química quântica ajuda a obter a entropia e, até certo ponto, os dados de entalpia. Cada molécula constituinte de uma substância gasosa pode ser vista como um sistema de núcleos carregados positivamente e elétrons carregados negativamente. Os pesquisadores podem então aplicar métodos de cálculo de estrutura eletrônica para resolver a equação molecular de Schrödinger. Isso revela a energia eletrônica total da molécula, sua função de onda, e a configuração espacial dos núcleos - isto é, sua estrutura geométrica 3-D. Os físicos podem então calcular a entropia e a entalpia de um gás ideal composto por tais moléculas. Os valores de entropia obtidos desta forma são então introduzidos em livros de referência e usados em cálculos termodinâmicos.
O problema com a entalpia é que, não sendo um valor fundamental neste ponto, depende significativamente do método escolhido para o cálculo da equação de Schrödinger.
As reações de atomização são geralmente empregadas para calcular a entalpia de formação. Em tais reações, o composto de interesse se divide em átomos individuais. Por exemplo, sulfeto de prata - Ag 2 S - produz um enxofre e dois átomos de prata. Uma vez que as entalpias de formação de substâncias atômicas são bem conhecidas e relatadas em livros de referência, é possível calcular a entalpia de formação da substância inicial - neste caso, sulfeto de prata - encontrando a mudança de entalpia na reação por meio de métodos de química quântica.
Contudo, quando as moléculas compostas de muitos átomos sofrem atomização, isso afeta a estrutura eletrônica de tal forma que a entalpia, também, é alterado significativamente. Os métodos atualmente disponíveis de química teórica não podem explicar esses efeitos com precisão suficiente.
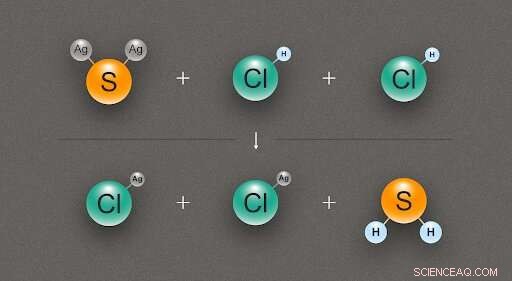
Figura 2. Um diagrama que ilustra a reação química entre um sulfeto de prata (Ag₂S) e duas moléculas de ácido clorídrico (HCl), produzindo duas moléculas de cloreto de prata (AgCl) e uma de sulfeto de hidrogênio (H₂S). Crédito:@ tsarcyanide / MIPT
A equipe de pesquisadores do MIPT, o Instituto Frumkin de Físico-Química e Eletroquímica da Academia Russa de Ciências, Universidade Estadual de Química e Tecnologia de Ivanovo, e a King Abdullah University of Science and Technology da Arábia Saudita publicou uma série de artigos propondo uma maneira de calcular as características termodinâmicas de compostos orgânicos e inorgânicos com mais precisão.
No caso do sulfeto de prata, os pesquisadores descobriram sua entalpia de formação a partir da reação com ácido clorídrico, que produz cloreto de prata e sulfeto de hidrogênio (fig. 2). Uma vez que o número de títulos na linha superior é o mesmo que na linha inferior, a mudança na energia pode ser calculada com o mínimo de erro.
O calor de formação do cloreto de prata, sulfato de hidrogênio, e o ácido clorídrico são conhecidos com alta precisão, e a modelagem por computador revela o efeito térmico da reação. A partir desses dados, é possível derivar o calor de formação do sulfeto de prata usando a lei de Hess.
"A abordagem clássica de cluster acoplado, conhecido como CCSD (T), é o padrão ouro para resolver a equação de Schrödinger eletrônica na química quântica moderna, "Minenkov explicou." Nós a substituímos pela versão local chamada DLPNO-CCSD (T), que foi desenvolvido há não muito tempo no Instituto Max Planck. Isso reduziu o poder de computação necessário em uma ordem de magnitude. Sob o CCSD convencional (T), o tempo de cálculo varia com o tamanho N da molécula como N 7 , portanto, não é uma opção para moléculas grandes. A versão local consome muito menos tempo e recursos. "
A equipe começou verificando se os resultados de seus cálculos de química quântica concordavam com os dados termodinâmicos e estruturais experimentais. Livros de referência relataram os valores para 10 compostos de prata, e eles eram uma boa combinação. Tendo, assim, garantido que seu modelo é adequado, os pesquisadores calcularam as características termodinâmicas de 90 compostos de prata ausentes nos livros. Os dados são úteis para cientistas que trabalham no campo da química da prata e para testar e calibrar novos métodos de cálculo de estrutura eletrônica.