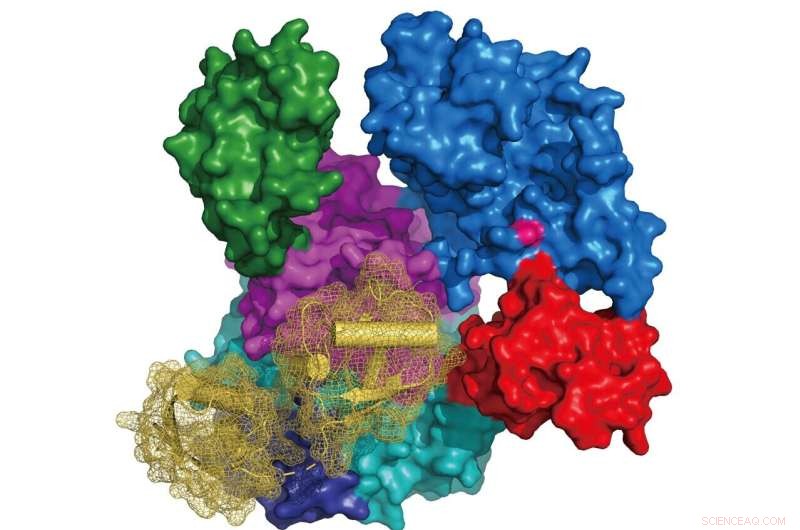
Imagem:Estrutura de UBA6 (representação de superfície colorida de acordo com sua arquitetura de domínio, sítio ativo cisteína em rosa) em complexo com FAT10 (diagrama de fita em amarelo com representação de superfície em malha). Crédito:Grupo Schindelin
Pesquisadores do Centro Rudolf Virchow da Universidade de Würzburg revelaram as estruturas cristalinas do UBA6 em complexo com ATP ou com a proteína FAT10, semelhante à ubiquitina. Esses resultados fornecem a base para estudar os papéis individuais de UBA6 para a ligação de ubiquitina ou FAT10 a proteínas-alvo e as vias celulares a jusante com possíveis implicações para a etiologia de certos tumores. Este estudo foi publicado na revista
Nature Communications .
A ubiquitilação de proteínas alvo é uma das modificações pós-traducionais mais importantes e desempenha papéis essenciais em vários processos celulares. A ubiquitilação é realizada por uma cascata enzimática sequencial de enzimas ativadoras de E1, enzimas de conjugação de E2 e enzimas de ligação de E3. Por muitos anos a UBA1 foi considerada a única enzima E1 que ativa a ubiquitina, até que em 2007 uma segunda enzima ativadora da ubiquitina foi descoberta:UBA6.
Um alvo potencial para o desenvolvimento de medicamentos UBA6 está presente apenas em vertebrados e ouriços-do-mar. Curiosamente, UBA6 é uma enzima E1 incomum, pois ativa a ubiquitina e a proteína semelhante à ubiquitina (Ubl) FAT10. Devido à sua gama restrita de eventos de ubiquitilação, em comparação com a ação da enzima ativadora de ubiquitina genérica UBA1, e sendo a única ligação de FAT10 catalisadora de E1, o UBA6 é considerado um potencial alvo de drogas. Para explorar ainda mais a inibição direcionada de UAB6, é essencial entender sua especificidade dupla e identificar variantes da enzima que são prejudicadas na ativação de ubiquitina ou FAT10.
O grupo de pesquisa do Prof Hermann Schindelin no Centro Rudolf Virchow da Universidade de Würzburg relata as primeiras estruturas de UBA6, em complexo com ATP ou FAT10. Curiosamente, seus estudos estruturais e de modelagem também revelaram como o UBA6 permite o reconhecimento duplo de ubiquitina e FAT10. Outra descoberta importante é a identificação de variantes de UBA6 que eliminam seletivamente a ativação de ubiquitina ou FAT10. "Esses resultados fornecem a base para estudar os papéis individuais que o UBA6 está desempenhando na ativação da ubiquitina ou FAT10 nas vias celulares a jusante", diz Schindelin.
Enredado em várias doenças Como a ubiquitilação e a FAT10ilação estão envolvidas em múltiplos processos celulares, não é de surpreender que o mau funcionamento de um ou mais componentes desse sistema leve a uma variedade de doenças. A degradação proteassômica mediada por UBA6 foi relatada como envolvida em estados fisiológicos e fisiopatológicos associados ao cérebro em camundongos. Curiosamente, descobriu-se que o UBA6 é superexpresso em cérebros humanos de pacientes com doença de Alzheimer. A proteína supressora de tumor p53 é um substrato de FAT10 e uma regulação duplamente negativa de FAT10 e p53 foi observada como crítica no controle da tumorigênese, que está de acordo com a superexpressão de FAT10 em muitos tipos de células cancerígenas.
Embora as previsões sobre a orientação da ubiquitina no complexo com UBA6 pudessem ser prontamente geradas com base na estrutura do complexo UBA6-ATP e nas estruturas UBA1-Ub disponíveis, parecia impossível prever como FAT10 e, em particular, seu domínio N-terminal ( NTD) iria interagir com UBA6. Assim, a determinação da estrutura do cocristal UBA6-FAT10 foi um passo crucial. Com base nas estruturas derivadas experimentalmente e no complexo modelo UBA6-ubiquitina, foi identificado um interruptor de seletividade que levou à descoberta subsequente de variantes de UBA6 abolindo seletivamente a ativação de qualquer modificador.
Estudos futuros de UBA6 com os mutantes seletivamente prejudicados são necessários para investigar possíveis ligações entre a ubiquitilação catalisada por UBA6 e a FAT10ilação no contexto do câncer. "Se relações causais puderem ser estabelecidas, a inibição direcionada de UBA6 por abordagens de triagem enzimática e in silico será conduzida", explica Schindelin. "Com o conjunto de mutans que prejudicam seletivamente a ubiquitilação ou FAT10ilação, investigaremos o comprometimento seletivo de qualquer processo em experimentos baseados em células com foco particular em células cancerígenas".
+ Explorar mais Equipe analisa com sucesso a estrutura da proteína FAT10 para uma possível terapia contra o câncer
