Pesquisadores descobrem a inesperada estrutura atômica do sensor de frio e mentol TRPM8
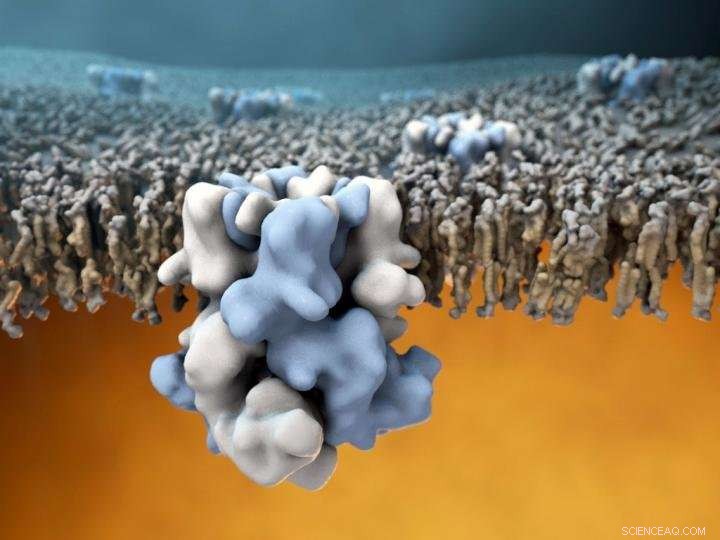 p O canal de íons TRPM8 (azul e branco no centro) está embutido na membrana externa das células, e é capaz de sentir temperaturas frias do lado de fora (a metade superior da imagem), e comunicar essa informação ao interior celular aquecido (metade inferior da imagem). Crédito:Gabe Lander e Graham Johnson
p O canal de íons TRPM8 (azul e branco no centro) está embutido na membrana externa das células, e é capaz de sentir temperaturas frias do lado de fora (a metade superior da imagem), e comunicar essa informação ao interior celular aquecido (metade inferior da imagem). Crédito:Gabe Lander e Graham Johnson
p Uma equipe de pesquisadores do The Scripps Research Institute (TSRI) e da Duke University fez a primeira determinação da estrutura atômica do Transient Receptor Potential Melastatin 8 (TRPM8), um sensor molecular em terminações nervosas que detecta temperaturas frias, bem como mentol e outros produtos químicos que induzem sensações de frio. p Essa descoberta deve impulsionar os esforços contínuos dos cientistas para direcionar o TRPM8 terapeuticamente. Compostos de drogas que interagem com o sensor de frio - como já fazem as pomadas contendo mentol - podem ser capazes de tratar algumas formas de dor crônica e inflamação, enxaquecas e até cânceres.
p "Conhecendo a estrutura atômica do TRPM8 e como ele reage ao frio, mentol e outros estímulos devem ajudar no projeto de novas drogas potentes e seletivas direcionadas a este sensor, "disse o líder do estudo Gabriel C. Lander, Ph.D., professor associado da TSRI, que co-liderou o estudo com o Dr. Seok-Yong Lee na Duke University School of Medicine.
p A descoberta, publicado em 7 de dezembro, 2017 no jornal
Ciência , também é um feito técnico significativo. Desde que a proteína de detecção de frio foi identificada pela primeira vez em 2002, equipes ao redor do mundo tentaram, mas não conseguiram determinar a estrutura atômica do TRPM8 usando cristalografia de raios-X, tradicionalmente, o método utilizado para resolver estruturas de proteínas grandes. A obtenção de uma estrutura de alta resolução do TRPM8 representou um grande desafio para os biólogos estruturais, em parte devido à instabilidade do canal quando isolado de seu ambiente nativo na membrana celular. Sem suporte de membrana, TRPM8 tem tendência a perder sua integridade estrutural, tornando o alvo muito difícil de estudar. A estrutura do sensor TRPM8 também é relativamente complexa, sendo composto por quatro cópias idênticas da proteína codificada pelo gene TRPM8.
p Para este projeto, Lander e co-primeiro autor Mengyu Wu, um estudante de graduação em seu laboratório, optou por usar microscopia crioeletrônica (crio-EM), um método de determinação de estrutura que é cada vez mais preferido para estudos estruturais difíceis. Lee e sua equipe começaram examinando proteínas TRPM8 de mais de uma dúzia de espécies animais diferentes, incluindo humanos, camundongos, e pássaros, para encontrar um que provavelmente seria "melhor comportado" para um estudo crio-EM. Eles se estabeleceram na proteína TRPM8 de uma ave chamada flycatcher.
p "Todas as evidências apontam para o TRPM8 do papa-moscas trabalhando da mesma forma que os TRPM8s de mamíferos, portanto, estamos confiantes de que nossa análise estrutural se traduzirá diretamente na forma humana deste sensor, "Lander disse.
p Os cientistas enfrentaram muitos obstáculos devido à instabilidade inerente do TRPM8 fora de seu ambiente de membrana nativo. "Mesmo dentro de um único dia após o envio das amostras da Duke para a TSRI, o complexo de proteínas começaria a se desfazer, "disse Wu." O laboratório de Lee estrategicamente adicionou algumas mutações estabilizadoras à proteína para que ela fosse menos propensa à degradação. "Ying Yin, um estudante de graduação no laboratório Lee, também voltou e meticulosamente rastreado através de várias condições de purificação para conferir estabilidade adicional à amostra.
p A proteína também se comportou de forma diferente da maioria das amostras que o laboratório Lander normalmente trabalha para microscopia eletrônica, e os pesquisadores levaram mais de um ano para identificar as condições certas para obter a imagem dessa biomolécula desafiadora.
p "Tivemos que jogar fora o livro de regras e repensar a abordagem usual para resolver esse tipo de estrutura, "disse Lander.
p Por meio dessas adaptações, os pesquisadores foram capazes de obter o primeiro vislumbre estrutural do TRPM8 com uma resolução geral de cerca de 4 Angstroms (0,4 bilionésimos de um metro). O modelo atômico resultante também continha algumas surpresas. "Outros grupos levantaram hipóteses sobre a estrutura do TRPM8 e como ele interage com parceiros de ligação, como mentol, mas o que descobrimos foi que praticamente todas essas suposições fundamentadas estavam muito distantes, "Lander disse. Em particular, o bolso de ligação para mentol acabou em um local inesperado, diferente do local de ligação do ligante em outros sensores TRP.
p "Uma coisa que essa estrutura nos diz é que os sensores TRP não funcionam todos da mesma maneira, e assim espero descobrir muitos novos mecanismos de sensor à medida que estudamos mais dessas estruturas TRP, "Lander disse.
p O TRPM8 é de interesse da indústria farmacêutica em parte por causa do analgésico, efeitos antiinflamatórios que pode ter quando ativado. Além disso, variantes de seu gene foram associadas a uma predisposição para enxaquecas, e os cientistas demonstraram que a manipulação do TRPM8 pode causar dores semelhantes às da enxaqueca em animais.
p "TRPM8 também é expresso de forma anormal em algumas próstatas, mama e outros cânceres, tornando-o um potencial alvo quimioterápico, "Wu disse.
p Embora o TRPM8 seja mais conhecido como um sensor de nervo periférico de temperaturas moderadamente frias (abaixo de cerca de 25 ° C) e de moléculas de sensação de frio, como mentol, também é encontrado em muitos outros tecidos normais, mesmo nas profundezas do corpo, e suas funções nesses tecidos permanecem pouco claras. Uma compreensão detalhada da interação estrutural do TRPM8 com seus parceiros de ligação naturais deve levar ao desenvolvimento de melhores sondas moleculares que podem ajudar os cientistas a revelar suas várias funções.
p Os Laboratórios Lander e Lee estão agora trabalhando para entender melhor como o TRPM8 interage com o mentol e outras moléculas parceiras de ligação terapêuticas.
