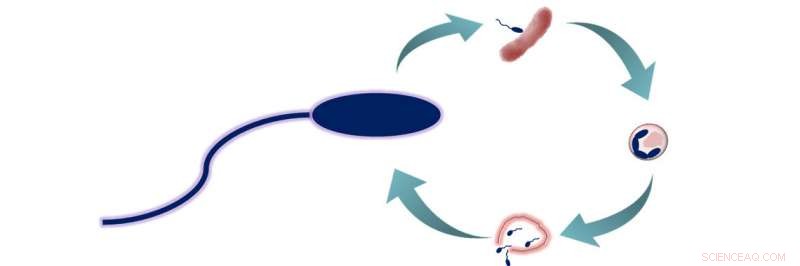
Ciclo de predação de B. bacteriovorus. B. bacteriovorus tem duas fases de vida:1) em busca de presas, e 2) entrar na presa e se alimentar. Durante esta segunda fase, as bactérias consomem suas presas de dentro, permitindo que cresçam e se alongem antes de se separarem em 3 a 6 novas células de B. bacteriovorus. Essas células então escapam da presa agora morta e começam um novo ciclo de vida. Crédito:American Chemical Society
Em 2016, a Organização Mundial de Saúde classificou a resistência aos antibióticos como "uma das maiores ameaças à saúde global, comida segura, e desenvolvimento hoje. "O anúncio citou uma lista crescente de infecções, como tuberculose e gonorréia, que estão se tornando mais difíceis de tratar a cada ano à medida que aumenta a resistência aos atuais tratamentos com antibióticos. No entanto, os antibióticos são essenciais - sem eles, a raça humana seria atormentada por infecções persistentes. Então, qual é a solução para garantir o tratamento contínuo e, ao mesmo tempo, abordar o aumento alarmante da resistência?
Uma solução potencial reside em um tipo único de bactéria predatória que se alimenta de outras bactérias, como aqueles que causam doenças. Chamado de "antibióticos vivos, “esse grupo de fauna carnívora tem chamado a atenção dos pesquisadores, incluindo os da Universidade de Graduação do Instituto de Ciência e Tecnologia de Okinawa (OIST). Em um artigo publicado recentemente em Biologia Sintética ACS , Os pesquisadores do OIST deram os primeiros passos em direção à manipulação genética de um desses pequenos canibais, B. bacteriovorus. Eles identificaram ferramentas que podem permitir a manipulação de genes que influenciam o comportamento predatório dessa bactéria.
"No futuro, queremos controlar a predação das bactérias - o momento e a extensão da predação, "explica o Dr. Mohammed Dwidar da Unidade de Química e Engenharia de Ácido Nucleico e primeiro autor do artigo." [No momento] não temos as ferramentas básicas de engenharia para fazer isso. "
B. bacteriovorus é inofensivo para os humanos, mas letal para sua presa - bactérias Gram-negativas - que inclui vilões como E. coli, Salmonella, Legionella, e outros. Como tal, ser capaz de controlá-lo poderia potencialmente tratar muitos tipos diferentes de infecções. Contudo, devido à sua natureza predatória incomum e outras características únicas, a manipulação genética de B. bacteriovorus foi limitada.
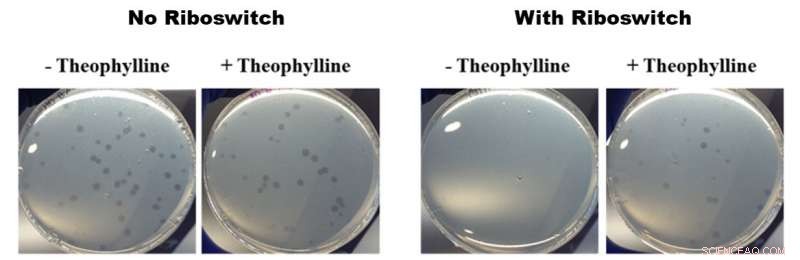
Efeitos de riboswitches ativados por teofilina no crescimento de B. bacteriovorus. Todas as fotos na figura acima mostram placas de petri contendo B. bacteriovorus e sua presa E. coli. As duas fotos à esquerda mostram o crescimento de B. bacteriovorus em placas que não contêm (-) e contêm (+) teofilina sem um riboswitch inserido no genoma. As duas fotos da direita mostram o crescimento de B. bacteriovorus modificado com riboswitch em placas que não contêm (-) e contêm (+) teofilina. As fotos da esquerda não mostram diferença no crescimento e as fotos da direita mostram um crescimento mais rápido na presença de teofilina, o que significa que os riboswitches ativados por teofilina tiveram um efeito sobre o comportamento predatório de B. bacteriovorus. Crédito:American Chemical Society
Os pesquisadores do OIST usaram riboswitches, que são ferramentas de controle de expressão gênica conhecidas por funcionar bem em outras bactérias, para enfrentar o desafio de compreender e manipular a predação de B. bacteriovorus. A forma como um gene é expresso segue um caminho específico - o DNA é convertido em RNA por meio da transcrição, O RNA é convertido em proteínas por meio da tradução, e então as proteínas desempenham funções diferentes. O riboswitch entra na fase de tradução. Ao colocar um riboswitch no início de uma fita de RNA, e então "ativando-o" com um produto químico, o riboswitch pode iniciar ou parar o RNA de ser traduzido em uma proteína.
Para seu estudo, os pesquisadores do OIST inseriram um riboswitch em um dos genes considerados importantes para o comportamento predatório de B. bacteriovorus:o fator sigma flagelar fliA. Eles então o ativaram com a teofilina química. Depois de colocar as bactérias modificadas em placas de Petri junto com algumas deliciosas presas de E. coli, o B. bacteriovorus modificado parecia se multiplicar mais rapidamente na presença de teofilina do que em sua ausência. Esta multiplicação mais rápida implica que B. bacteriovorus estava consumindo sua presa mais rápido, e assim se multiplicando mais rápido. Isso, por sua vez, mostra que o ciclo de vida predatório pode ser controlado pela teofilina.
Além do objetivo final de "antibiótico vivo", existem muitos outros usos potenciais para células de B. bacteriovorus facilmente manipuláveis. “As pessoas querem comida orgânica sem produtos químicos, "Dr. Dwidar explica." A bactéria predatória pode ser uma alternativa potencialmente segura aos agentes antibacterianos para algumas doenças de plantas. Também podemos usá-lo para a indústria, por exemplo, em estações de tratamento de água. "
"No futuro, você pode borrifar essas bactérias em alimentos frescos para proteger contra intoxicação alimentar, "Professor Yohei Yokobayashi, que também estava envolvido na pesquisa, acrescenta.
Com os resultados dos pesquisadores do OIST em mãos, o próximo passo é aprender mais sobre B. bacteriovorus e as ferramentas que podem ser capazes de controlar seu comportamento para um dia realizar todo o seu potencial antibiótico.