 É uma célula de câncer de mama capturada por um microscópio eletrônico de varredura, que produz uma imagem 3-D. Imagem cedida por Bruce Wetzel e Harry Schaefer) / O site do National Cancer Institute
É uma célula de câncer de mama capturada por um microscópio eletrônico de varredura, que produz uma imagem 3-D. Imagem cedida por Bruce Wetzel e Harry Schaefer) / O site do National Cancer Institute Graças a um artigo de opinião do New York Times de 2013, todos nós sabemos sobre a decisão de Angelina Jolie de fazer uma dupla mastectomia preventiva para reduzir o risco de desenvolver câncer de mama no futuro. Seus comentários sinceros revelaram que ela tem um forte histórico familiar da doença e, com base nos resultados de testes genéticos, uma forma mutada do gene conhecido como BRCA1, o que dá a ela 87 por cento de chance de ter câncer de mama e 50 por cento de chance de câncer de ovário [fonte:Jolie]. Diante dessa realidade, que pode ser mais ou menos grave para pessoas diferentes, ela optou por remover os dois seios antes que as células que compõem suas glândulas produtoras de leite pudessem se transformar em células cancerosas nocivas, capazes de crescimento descontrolado.
Se o procedimento a proteger desta doença, como a probabilidade sugere, ela terá muitas pessoas para agradecer:os conselheiros genéticos, os cirurgiões, e a família dela, claro, para nomear alguns.
Mary-Claire King pode não estar nessa lista. Um professor de ciências do genoma e genética médica da Universidade de Washington, King ajudou a desvendar a base genética do câncer de mama hereditário. Seu trabalho levou primeiro à descoberta do BRCA1 em 1994 e, em seguida, um ano depois, para BRCA2. Mulheres e homens, também, como se constatou) que carregam formas mutantes desses genes são muito mais propensos a desenvolver vários tipos de câncer, incluindo seio, câncer de ovário e de próstata.
A própria King frequentemente aponta para outro VIP - Paul Broca, um patologista francês que propôs pela primeira vez na década de 1860 que o câncer de mama pode ocorrer em famílias. A esposa de Broca sofria de câncer de mama de início precoce, e quando ele estudou sua árvore genealógica, ele descobriu que a doença pode ser rastreada por quatro gerações. Quando King foi nomear o gene que ela descobriu, ela queria chamá-lo de BROCA para homenagear o francês, mas ela só tinha quatro letras. O nome final - BRCA - abrevia "Broca" enquanto representa " br leste ca ncer "e talvez até Berkeley, Califórnia, onde King fez seu trabalho de doutorado [fonte:Check].
Nomenclatura à parte, os genes BRCA são uma história de sucesso da genética moderna, provar que os biomarcadores podem prever com segurança a predisposição de uma pessoa para desenvolver uma doença ou condição. Há cerca de uma década, impulsionado pelo sucesso do Projeto Genoma Humano, pensadores avançados prometeram um tempo em que as moléculas biológicas encontradas no corpo serviriam como indicadores de fenômenos como doenças, infecção ou exposição ambiental. Esses sinalizadores levariam à erradicação do câncer e de outras condições perniciosas. Mas uma coisa engraçada aconteceu no caminho para a utopia:os biomarcadores mostraram-se difíceis de identificar. E quando eles eram, os pesquisadores não conseguiram desenvolver ensaios suficientemente sensíveis ou econômicos para torná-los ferramentas de diagnóstico valiosas.
Portanto, a comunidade médica deu as boas-vindas à descoberta dos genes BRCA, e o desenvolvimento de testes genéticos confiáveis para identificá-los em indivíduos, com os braços abertos. Tudo isso levou ao próximo desafio:garantir que o público entenda o que são esses genes.
Conteúdo
Os seios são estruturas incríveis. Eles são tão únicos no reino animal que sua presença define todo um grupo de organismos - a palavra "mamífero" vem de "mamário, "de onde vem" mamãe , "a palavra latina para peito, úbere ou tetina. Os biólogos classificam os seios como glândulas exócrinas , ou estruturas que secretam seus produtos por meio de dutos para o ambiente externo. Isso não é o mesmo que glândulas endócrinas , que secretam seus produtos diretamente na corrente sanguínea.
O produto feito de seios, claro, é leite. O leite chega ao mundo exterior através do mamilo, mas começa sua vida mais profundamente no seio, em grupos de células conhecidas como alvéolos. Esses aglomerados formam lóbulos, que criam estruturas maiores conhecidas como lóbulos. À medida que os alvéolos produzem leite, o líquido passa por tubos finos - dutos lactíferos - que levam a aberturas no mamilo. Tecido fibroso e gordura preenchem os espaços entre os lóbulos e os dutos, e toda a estrutura fica no topo dos músculos peitorais do tórax. Uma rede de vasos linfáticos e nódulos envolve todo esse tecido e se estende para cima na axila.
Em muitas mulheres, este tecido funciona corretamente e nunca causa problemas. Próximo, no entanto, veremos o que acontece quando isso acontece.
Nomeando o CâncerOs médicos e oncologistas classificam os cânceres de mama com base no local onde se desenvolvem. Alguns cânceres se originam nas células que revestem o ducto mamário. Estes assim chamados carcinomas ductais são o tipo mais comum de câncer de mama, ocorrendo em 70 por cento das mulheres diagnosticadas com a doença [fonte:National Cancer Institute]. Os alvéolos que constituem os lóbulos também podem abrigar tumores cancerígenos. Carcinomas lobulares são muito menos comuns e representam apenas 1% dos casos de câncer de mama [fonte:National Cancer Institute]. Algumas mulheres até têm uma mistura dos tipos de câncer ductal e lobular .
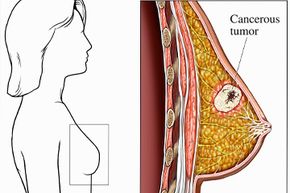
Às vezes, as células que compõem o tecido mamário podem começar a crescer sem controle, expulsando as células normais de produção de leite. Enquanto esses valentões desinibidos empurram e abrem caminho, eles formam uma massa de tecido conhecida como caroço ou tumor. Se o caroço permanecer contido e não invadir os lóbulos circundantes ou outras partes do corpo, é classificado como benigno. Se, Contudo, continua a invadir a mama circundante e se espalha para os nódulos linfáticos, é classificado como maligno ou canceroso.
Os cientistas agora sabem que o câncer é causado por danos ao DNA - uma mutação - em genes que regulam o crescimento e a divisão celular. Muitas mutações surgem quando alguém é exposto a certas condições ambientais, como radiação. As células da mama não são imunes a essas mutações adquiridas (ao contrário das herdadas). Na verdade, dois tipos de câncer de mama ocorrem quando o DNA é danificado como resultado de carcinógenos ou vírus ambientais.
O primeiro tipo afeta como os hormônios, como estrogênio, interagir com as células da mama. Durante o ciclo menstrual mensal de uma mulher, Os níveis de estrogênio aumentam na mama para preparar o tecido para produzir leite. As moléculas de estrogênio se ligam a receptores nas células da mama, provocando a proliferação das células. Se uma mulher não engravidar, todas essas células extras produtoras de leite se deterioram e morrem. As vezes, no entanto, esse processo de proliferação pode ficar descontrolado se certas células da mama albergam DNA danificado. Quando essas células comprometidas recebem o sinal do estrogênio, eles se multiplicam como deveriam, mas eles não param e não morrem no final de um ciclo.
Outra mutação adquirida afeta o gene que codifica uma proteína conhecida como receptor 2 do fator de crescimento epidérmico humano , abreviado HER2 . Normalmente, As proteínas HER2 na superfície das células mamárias respondem a fatores de crescimento - substâncias químicas que dizem às células mamárias como crescer adequadamente. As proteínas HER2 recebem esses fatores, em seguida, coloque as instruções dentro da célula. Se o DNA do gene HER2 for danificado, Contudo, sua atividade pode aumentar a níveis perigosos. Ele pode produzir muita proteína HER2 e, como resultado, causar crescimento desordenado de células mamárias.
Nem os cânceres estrogênio positivo nem HER2-positivo podem ser transmitidos a outros membros da família porque as mutações afetam apenas as células da mama. Esse não é o caso do câncer de mama hereditário. Nesta forma da doença, uma mutação é carregada no espermatozóide ou óvulos dos pais e passada, na fertilização, para sua prole. Essas mutações aparecem em todas as células do corpo e predispõem a pessoa a desenvolver câncer. Os cientistas descobriram vários genes ligados ao câncer de mama hereditário, incluindo a sigla pesadelos p53, PTEN / MMAC1, CHEK2 e ATM. Mas os genes BRCA são os mais conhecidos e talvez os mais intensamente estudados. Na próxima seção, vamos dar uma olhada mais de perto na árvore genealógica dos genes BRCA.
Graças a Watson, Crick e milhares de outros, sabemos muito sobre a base química da hereditariedade. Caso você tenha esquecido ou bloqueado de sua memória, lembre-se de que o núcleo de uma célula humana contém cromossomos - as estruturas filiformes que carregam todas as nossas informações genéticas. As células humanas têm 23 pares de cromossomos, para um total de 46. Cada cromossomo consiste em uma dupla hélice de DNA carregando uma sequência linear de genes, enrolado em torno de proteínas conhecidas como histonas. Um único gene é uma sequência distinta de nucleotídeos, os blocos de construção do DNA, que codifica para uma proteína correspondente.
Enquanto os cientistas investigavam o genoma humano, eles notaram que alguns genes compartilhavam certas características. Eles carregavam uma sequência semelhante de nucleotídeos, ou eram genes diferentes que produziram proteínas capazes de participar do mesmo processo celular. Eles agruparam esses genes em famílias e então usaram o sistema de classificação para prever a função de genes recém-identificados com base em suas semelhanças com genes conhecidos.
Existem dois genes BRCA - BRCA1 e BRCA2 - e cada um pertence a uma família diferente. BRCA1 pertence à família de genes RNF, que codificam proteínas conhecidas como proteínas de dedo de zinco do tipo RING. Essas proteínas são assim chamadas porque a molécula de proteína tem regiões que se dobram em torno de um íon zinco e porque a forma resultante dessa região lembra um dedo. A forma única das proteínas de dedo de zinco do tipo RING permite que elas se liguem prontamente a outras moléculas, especialmente proteínas e ácidos nucléicos. Uma vez que eles estão ligados a outra molécula, eles executam alguma ação enzimática que ajuda a célula a manter um ambiente estável. Algumas dessas atividades incluem crescimento e divisão celular, transdução de sinal, degradação de proteínas e, como veremos na próxima seção, supressão de tumor.
Os genes BRCA2 pertencem à família de genes FANC. Os genes desse grupo produzem um complexo de proteínas que participam de um processo conhecido como via da anemia de Fanconi (AF). Esta via funciona principalmente na localização e reparação de danos no DNA. Em particular, as proteínas têm como alvo seções de DNA onde as fitas opostas da dupla hélice não estão devidamente ligadas. Quando eles encontram essa área, as proteínas FANC se ligam ao DNA e reconstroem as ligações cruzadas, permitindo que o DNA se replique e funcione normalmente.
Claramente, as famílias de genes RNF e FANC desempenham papéis importantes em nos manter saudáveis. Se algo interfere na função desses genes, pode levar a várias doenças. Por exemplo, a interrupção dos genes RNF pode levar à distrofia miotônica, que é caracterizada por perda e perda muscular progressiva. A interrupção dos genes FANC pode resultar em, você adivinhou, Anemia de Fanconi, que pode causar falha da medula óssea, anormalidades físicas e defeitos de órgãos. E, claro, ambas as famílias de genes desempenham um papel em certos tipos de câncer, incluindo câncer de mama.
A seguir, vamos olhar muito especificamente para BRCA1 e BRCA2 para entender como eles funcionam normalmente e como as mutações nos genes levam ao câncer de mama.
Mary-Claire King pode ter querido homenagear Paul Broca dando o nome dele à BRCA, mas os geneticistas modernos conhecem os genes por seus nomes oficiais:"câncer de mama 1, início precoce "e" câncer de mama 2, início precoce. "Você também pode ouvir" genes de suscetibilidade ao câncer de mama 1 e 2 "ou" câncer de mama hereditário 1 e 2. "Com nomes semelhantes, você pode pensar que os dois genes residem juntos no mesmo cromossomo. Esse não é o caso. A localização exata do BRCA1 é 17q21; BRCA2 é 13q12.3. Aqui está o que esses números significam:
Mesmo que BRCA1 e BRCA2 pertençam a famílias de genes diferentes, ambos produzem grandes proteínas que participam da supressão do tumor quando estão trabalhando normalmente. A proteína BRCA1 consiste em 1, 863 aminoácidos e BRCA2 de 3, 418 aminoácidos [fonte:van der Groep]. A proteína BRCA1 exerce seus efeitos de supressão tumoral ao colaborar com uma série de outras proteínas para consertar quebras no DNA. Esses complexos de proteína BRCA1 provavelmente afetam vários processos de reparo de DNA, incluindo recombinação homóloga (troca de uma sequência de nucleotídeos por outra fita semelhante de DNA), reparo por excisão de nucleotídeos (corte de bases de DNA danificadas e colagem em novas) e junção de extremidades não homólogas (costura de uma quebra de fita dupla novamente). A proteína BRCA2 também participa do controle de danos ao DNA, mas parece ser muito mais limitado. Os cientistas acham que a proteína BRCA2 regula a atividade de um número menor de proteínas companheiras, incluindo RAD51 e PALB2, para dirigir a recombinação homóloga de DNA danificado.
Agora imagine o que aconteceria se você removesse os genes BRCA de uma célula ou jogasse uma chave inglesa em sua maquinaria molecular. Sem suas proteínas associadas, vários processos de reparo de DNA deixariam de funcionar e, hora extra, quando as células foram expostas à radiação ou agentes químicos, mais e mais defeitos se acumulariam. Essas mutações acabariam fazendo com que as células ficassem instáveis e se tornassem cancerosas.
Isso é exatamente o que acontece quando os genes BRCA ficam comprometidos. Uma mutação em um dos genes embaralha seu manual de instruções. Como resultado, o gene não tem mais a capacidade de construir versões corretas de sua proteína relacionada. A proteína pode ser anormalmente curta ou pode não ter a sequência correta de aminoácidos. Essas proteínas defeituosas não podem mais participar do processo de reparo do DNA, o que eventualmente leva à proliferação de células carregando DNA danificado. Se essas células revestem os dutos de leite do tecido mamário, um caroço ou tumor, criado por uma massa de células anormais, pode desenvolver lá. Além do câncer de mama, As mutações BRCA também podem levar ao câncer de ovário, câncer de trompa de Falópio, câncer pancreático e câncer de próstata.
Infelizmente, a natureza encontrou muitas maneiras de interromper os genes BRCA. A data, cientistas identificaram mais de 1, 000 mutações no gene BRCA1 e mais de 800 mutações no gene BRCA2 [fontes:Genetics Home Reference, Referência de Genética Home]. E lembre-se, esses genes defeituosos podem ser passados de uma geração para a próxima, o que significa que as pessoas que herdam a mutação a carregam consigo por toda a vida. Ele fica em suas células, passar despercebido até que um câncer se desenvolva ou até que alguém tome medidas para evitar que isso aconteça. É aí que entra o teste genético.
Aprender sobre as mutações BRCA pode deixar qualquer pessoa ansiosa. É fácil pensar que você pode ser suscetível ao câncer porque carrega um dos genes defeituosos. Na realidade, apenas cerca de 5 a 10 por cento de todos os casos de câncer de mama nos Estados Unidos são devidos a mutações genéticas herdadas [fonte:Susan G. Komen for the Cure]. Isso significa que quase todos os cânceres de mama se desenvolvem como resultado de mutações espontâneas ou adquiridas não relacionadas à hereditariedade. A maioria das mulheres, Portanto, não se beneficiaria de testes genéticos.
Como você sabe? As diretrizes a seguir podem ajudá-lo a decidir se deseja realizar o teste de mutações do gene BRCA. Você deve considerar o teste se atender a qualquer um dos seguintes critérios, conforme proposto por Susan G. Komen for the Cure, uma organização sem fins lucrativos dedicada a erradicar o câncer de mama por meio de pesquisas, divulgação e defesa da comunidade:
Um teste simples pode revelar se a mutação existe ou não em suas células. Na maioria dos testes, um técnico colherá uma amostra de seu sangue. Em outros testes, você usa um enxágue oral. Cada método permite que a instalação de teste obtenha células - e material genético - de seu corpo. Em um laboratório, os cientistas analisam esse material para procurar mudanças nos genes BRCA reais ou nas proteínas codificadas por esses genes. O teste leva três ou quatro semanas e pode custar centenas ou milhares de dólares.
Se você receber um resultado de teste positivo, então você sabe que herdou uma mutação conhecida em BRCA1 ou BRCA2. E ter uma mutação BRCA aumenta muito o risco de câncer - até 50% para desenvolver câncer de mama aos 50 anos e até 87% para desenvolver câncer de mama aos 70 [fonte:Myriad Genetics]. Um conselheiro genético pode ajudá-lo a avaliar esse risco e decidir que ação tomar. Uma opção, claro, é manter vigilância com mamografias de rotina e exames clínicos das mamas, com o objetivo de detectar um câncer precocemente, quando é mais tratável. Outra opção envolve tomar medicamentos, como tamoxifeno, para reduzir o risco de desenvolver câncer. E, finalmente, você pode assumir a liderança de Angelina Jolie e optar pela cirurgia profilática - removendo o máximo possível do tecido suscetível ao câncer.
Não há garantias, Contudo. Mesmo com uma dupla mastectomia preventiva, o câncer de mama ainda pode se desenvolver se a cirurgia não remover todo o tecido de risco. E, no entanto, esta era moderna da medicina baseada na genética levou a uma verdadeira revolução na detecção e tratamento do câncer de mama, e é por isso, desde 1990, houve um declínio de 33% na mortalidade por câncer de mama nos Estados Unidos [fonte:Susan G. Komen for the Cure].
Genes BRCA em HomensOs homens também desenvolvem câncer de mama, embora em taxas significativamente mais baixas do que as mulheres. Como você pode esperar, os genes BRCA desempenham um papel nesta forma da doença. Os cientistas agora acreditam que o câncer de mama masculino está mais fortemente ligado a mutações no gene BRCA2. O mesmo gene defeituoso também pode aumentar o risco de câncer de próstata e de pâncreas. Tal como acontece com as mulheres, homens que detectam câncer de mama e começam o tratamento precocemente têm maior probabilidade de sobreviver à doença.
A história do câncer de mama é incrível em muitos níveis diferentes - a ciência por trás da descoberta dos genes BRCA, o impressionante aumento da sobrevivência e a franqueza com que todos nós agora falamos sobre a doença. Mas o que me surpreende ainda mais é a complexidade ultrajante de nossa maquinaria celular, com compactação e descompactação de DNA e complexos de proteínas reunidos para manter nossas informações genéticas intactas e funcionais.