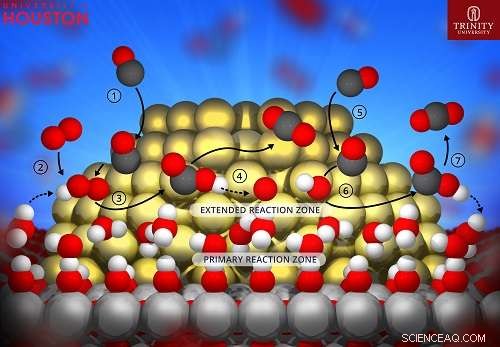
Representação esquemática da via de menor energia para a oxidação do CO em catalisadores de ouro-titânia. A camada de água no suporte de titânia estende a zona de reação no nanocluster de ouro e fornece prótons que auxiliam na etapa de dissociação do oxigênio. Crédito:Hieu Doan, Universidade de Houston
Pesquisadores da University of Houston e da Trinity University forneceram pela primeira vez evidências diretas de um mecanismo de reação mediado pela água para a oxidação catalítica do monóxido de carbono.
O trabalho usou nanopartículas de ouro e dióxido de titânio como catalisador para acelerar o processo e determinou que a água serve como co-catalisador para a reação que transforma o monóxido de carbono em dióxido de carbono. Enquanto os pesquisadores trabalharam com a oxidação do monóxido de carbono usando catalisadores de ouro por anos e perceberam que a água pode alterar a reação, nenhum deles foi capaz de explicar completamente por que funcionou.
O trabalho está descrito na edição de 5 de setembro da revista. Ciência .
"Podemos dizer com alto grau de certeza que agora entendemos o papel de cada um dos componentes e o que eles fazem durante essa reação catalítica, "disse Lars Grabow, professor assistente de engenharia química e biomolecular na Universidade de Houston. Ele e Hieu Doan, um Ph.D. estudante da UH Cullen College of Engineering, desenvolveu simulações computacionais para apoiar experimentos executados pelos químicos Bert Chandler da Trinity University, Christopher Pursell e Johnny Saavedra.
Chandler, professor de química na Trinity, disse que o trabalho foi uma verdadeira colaboração.
"Foi preciso todos nós para que isso acontecesse, "disse ele." O que fizemos foi preencher a lacuna entre a ciência da superfície e as pessoas da computação. Sabíamos que a água ajudava na reação, mas não entendíamos totalmente seu papel. Agora sabemos que a água é um cocatalisador para essa reação. "
Quando usado em joias, o ouro é valorizado por suas propriedades não reativas - não enferruja ou mancha quando exposto ao ar ou à água. E os pesquisadores sabem há muito tempo que, apesar de sua reputação como um metal inerte, nanopartículas de ouro podem funcionar como um catalisador para acelerar a reação química.
Mas ninguém sabia exatamente por que funcionava. Água acabou sendo a chave, mesmo quando não é explicitamente adicionado ao processo, Grabow disse.
Traços de água retirada do ar impulsionaram as reações na superfície dos catalisadores de ouro, ele disse.
Durante os experimentos e estudo computacional, os pesquisadores observaram como a água, hidroxilas de superfície e a interface metal-suporte interagiram durante a oxidação do monóxido de carbono sobre um catalisador de ouro-titânia.
"Em todos os casos, uma transferência de prótons essencialmente sem barreiras reduziu a energia geral do sistema, gerando H2O2 ou OOH. Uma vez que o OOH se formou, ele migrou ao longo da partícula Au, permitindo átomos próximos, mas não estritamente em, a interface de suporte de metal para participar da reação, "eles escreveram para descrever suas descobertas, referindo-se à geração de peróxido de hidrogênio ou hidroperoxila e migração de hidroperoxila ao longo das partículas de ouro.
Essencialmente, eles descobriram que os prótons de uma fina camada de água que se estende pela superfície do catalisador se separam das moléculas de água e se ligam às moléculas de oxigênio, movendo-se brevemente sobre a superfície do catalisador para estimular a reação antes de retornar à camada de água.
Modelos anteriores normalmente focavam em componentes individuais da reação, Grabow disse, tornando este projeto o primeiro a reunir todas as facetas em um único modelo que suporta totalmente as observações experimentais dos químicos da Trinity. Chandler disse que o trabalho pode fornecer uma maneira de produzir hidrogênio limpo a partir do petróleo e do gás natural.