Ilustrações esquemáticas de bio-NGs de acoplamento eletromecânico modulando a atividade celular inspirada por ECM. (A) As fibras de colágeno na ECM convertendo a força inerente da célula em bioeletricidade, que também constitui a arquitetura 3D do ECM. Esses sinais bioelétricos são transmitidos por moléculas de sinal preenchidas entre as fibras de colágeno, portanto, para regular a atividade celular e realizar a expressão funcional das células. (B) Diagrama esquemático das fibras piezoelétricas bioinspiradas em bio-NGs. A interação de células com bio-NGs emulando este sinal bioelétrico em ECM induz, em resposta às forças inerentes produzidas pelas células, um campo elétrico local que estimula e modula sua atividade celular. Crédito:Science Advances, 10.1126 / sciadv.abh2350 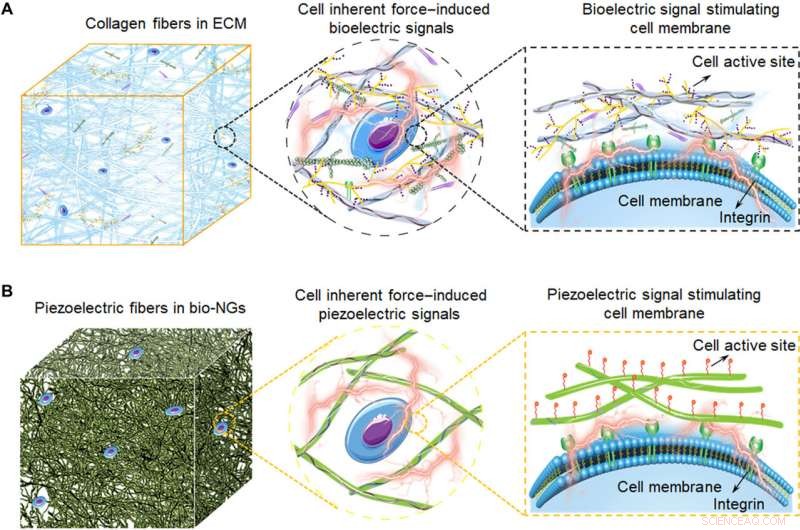
O espaço 3D exclusivo dentro dos bio-NGs forneceu um ambiente semelhante ao ECM para promover o crescimento celular. Os bio-NGs promoveram efetivamente a viabilidade e o desenvolvimento celular para manter sua expressão funcional específica. Os pesquisadores esperam que os novos e avançados bio-NGs imitem a complexidade da matriz extracelular e forneçam um sistema biológico in vivo fisiologicamente relevante. O dispositivo efetivamente promoveu a viabilidade e o desenvolvimento celular para manter sua expressão funcional específica. Li et al. Esperamos que a nova e avançada versão de bio-nanogeradores forneça um sistema biológico in vivo fisiologicamente relevante para substituir sistemas 2D e modelos animais imprecisos.
Orientação para células
Nesse trabalho, Li et al. delineou uma estratégia prática para a estimulação elétrica sem fio de células e tecidos para reparar e manter a função celular. A bioeletricidade é uma sugestão biofísica que fornece orientação para o crescimento e diferenciação celular durante o desenvolvimento embrionário e a regeneração do tecido. A bioeletricidade endógena existe no citoplasma e no espaço extracelular, fornecendo aos cientistas um recurso para estimulação elétrica de células excitáveis e regulando a atividade celular para aplicações biomédicas. A maioria dos métodos de tratamento requer uma entrada de energia externa e conexão de fio para aplicar pulsos elétricos externos por meio de microdispositivos implantados. Desenvolvimentos recentes em nanotecnologia permitiram tratamentos sem eletrodos e sem bateria, que incluem o uso de nanogeradores para estimulação cerebral, regeneração capilar e cicatrização de feridas. Contudo, a maioria deles requer uma solução bem aceita para estimular eletricamente as células funcionais. Li et al. foram, portanto, inspirados pela função biológica e microestrutura das fibras de colágeno na matriz extracelular para formar bio-NGs compostos de fibras eletrofiadas piezoelétricas altamente discretas para fornecer às células um microambiente fisicamente relevante. A interação bio-NG-célula se aplica a ambientes in vivo para reduzir a inflamação, induzir a proliferação de hepatócitos, e acelerar a angiogênese, bem como promover a reparação do fígado.
Representação esquemática e análise piezoelétrica de bio-NGs. (A) Diagrama esquemático da fabricação de fibras piezoelétricas Fe3O4 / PAN altamente discretas. Com a ajuda do ímã de neodímio ferro boro, Nanopartículas magnéticas de Fe3O4 foram introduzidas na solução de eletrofiação PAN para romper a tensão superficial da água. (B) A camada condutora PEDOT foi carregada com o método de polimerização in situ; Nanofolhas GO foram adsorvidas na camada mais externa de fibras pela contribuição da força de adsorção eletrostática para formar as fibras GO / PEDOT / Fe3O4 / PAN alvo. Imagens de microscopia eletrônica de transmissão de uma única fibra obtidas em todas as etapas. (C a E) Imagem óptica e imagens de microscopia eletrônica de varredura (SEM) dos bio-NGs. A inserção de (D) mostra a distribuição do tamanho dos poros e a porosidade. A inserção de (E) mostra a faixa de distribuição do diâmetro da fibra das fibras GO / PEDOT / Fe3O4 / PAN. (F) Simulação de análise de elemento finito de fibras piezoelétricas acopladas a uma célula viva gerando uma tensão máxima de 141 mV quando tensionada por uma força tangencial de 10 nN. (G) Potencial piezoelétrico gerado por uma única fibra em função da força celular tangencial aplicada. (H) Circuito resistor-capacitor simplificado criado pelo NG, a interface da célula NG, e a membrana celular. (I) Microscopia de força piezoelétrica (PFM) fase e imagens de amplitude de PFM de uma única fibra em bio-NGs. (J) Histerese de potencial elétrico de fase e loops de amplitude borboleta de fibras em bio-NGs, obtido com uma tensão DC variando de −10 a 10 V. (K) Tensão de saídas dos bio-NGs sob a mesma força de impacto de 1 N (azul) e sob uma vibração de 0,7 Hz (vermelho). A inserção representou os métodos de impacto (esquerda) e vibração (direita) usados para caracterizar as fibras em bio-NGs. F, força. Crédito da foto:Chuanmei Shi, Universidade de Ciência e Tecnologia de Nanjing. Crédito:Science Advances, 10.1126 / sciadv.abh2350 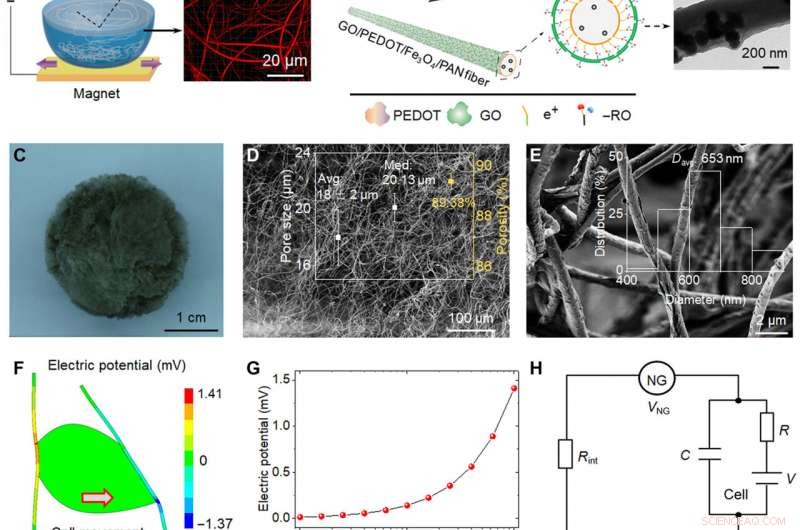
Durante os experimentos, a equipe de pesquisa introduziu nanopartículas magnéticas de óxido de ferro em poliacrilonitrila para preparar fibras altamente discretas para uso como um dispositivo de eletrofiação magnética. Durante a eletrofiação, a configuração permitiu a formação de andaimes com poros bem interconectados e fibras discretas para migração livre de células. Para preparar um microambiente mais próximo do in vivo, a equipe também transmitiu bioeletricidade como uma dica biofísica. Para conseguir isso, os cientistas desenvolveram uma estrutura de alvo para promover a interação celular e a adesão com as fibras. O acoplamento eletromecânico de bio-NGs montados pelo scaffold promoveu a transmissão e comunicação de sinais entre as células para mimetizar os efeitos bioelétricos das fibrilas ou fibras de colágeno na matriz extracelular. A equipe simulou e estudou o potencial piezoelétrico gerado a partir da força celular em bio-NGs usando a análise de elementos finitos. Para conseguir isso, eles aplicaram uma força de carga ao contato célula-fibra e primeiro mediram a piezoeletricidade de uma única fibra dentro de bio-NGs usando microscopia de força piezoelétrica. Os sinais experimentais de tensão validaram a piezoeletricidade teórica dos bio-NGs.
Caracterizando os bio-NGs e regulando a atividade celular
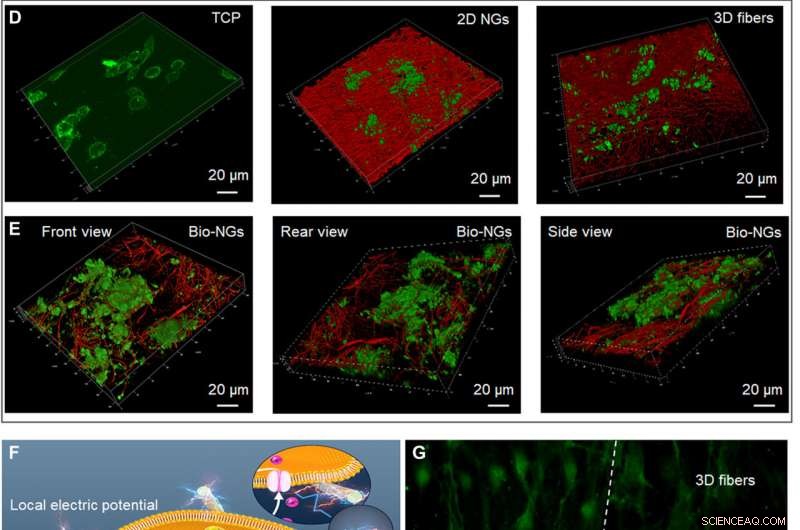
O crescimento e desenvolvimento de neurônios RGC5 em bio-NGs. (A) Proliferação de neurônios RGC5 pelo ensaio de DNA nos dias 1, 3, e 5. (B) Apoptose de neurônios RGC5 após 5 dias de cultura em bio-NGs. (C) Crescimento da neurita de neurônios RGC5 pelo comprimento médio da neurita após 5 dias de cultura em bio-NGs. (D) varredura confocal 3D de neurônios RGC5 cultivados em TCP, 2D NGs, e fibras 3D. (E) varredura confocal 3D de neurônios RGC5 cultivados em bio-NGs de diferentes perspectivas. (F) Força celular inerente de células vivas cultivadas em bio-NGs. Isso induziria um campo elétrico local proporcional ao nível de deformação que poderia eventualmente alterar o potencial de membrana e / ou a configuração dos receptores de membrana e resultar na abertura dos canais de Ca2 +. Ins3P, trifosfato de inositol. PLC, fosfolipase C. (G) As imagens de fluorescência das células pré-incubadas com Fluo-4 AM (permeável à membrana e corante dependente de Ca2 +) nas fibras em bio-NGs e fibras 3D. Verde, Ca2 +. Todas as barras de erro indicam ± SD. Crédito:Science Advances, 10.1126 / sciadv.abh2350
Para investigar as informações das fibras em bio-NGs, a equipe usou espectros de infravermelho com transformada de Fourier (FTIR) e difração de raios-X (XRD). Eles então estudaram as propriedades termodinâmicas das fibras piezoelétricas em bio-NGs usando termogramas de calorimetria de varredura diferencial (DSC) e conduziram estudos de voltamograma cíclico para testar o armazenamento de carga e as propriedades de transmissão das fibras piezoelétricas em bio-NGs. A equipe então testou a resiliência compressiva e as propriedades mecânicas das fibras, primeiro formando formas cilíndricas delas e comprimindo os andaimes para entender a excelente resiliência das construções. As propriedades mecânicas e a resiliência das fibras garantiram que os bio-NGs pudessem efetivamente manter um tamanho de poro grande o suficiente e um microambiente de crescimento 3D estável para o movimento e crescimento celular. A equipe também investigou a interação das células NG no espaço 3D com duas linhas celulares diferentes, incluindo
célula ganglionar retinal 5 (RGC5) e hepatócitos primários. As células continham canais de cálcio dependentes de voltagem em suas membranas e outras eram células móveis com altas funções metabólicas. Usando nanogeradores bidimensionais (NGs) e fibras 3D não piezoelétricas, a equipe estudou os efeitos do espaço 3D e da estimulação elétrica nas células. Os dados mostraram como os bio-NGs podem fornecer um microambiente de cultura de células biofriendly para futuros experimentos.
Promoção de reparo hepático in vivo com bio-NGs
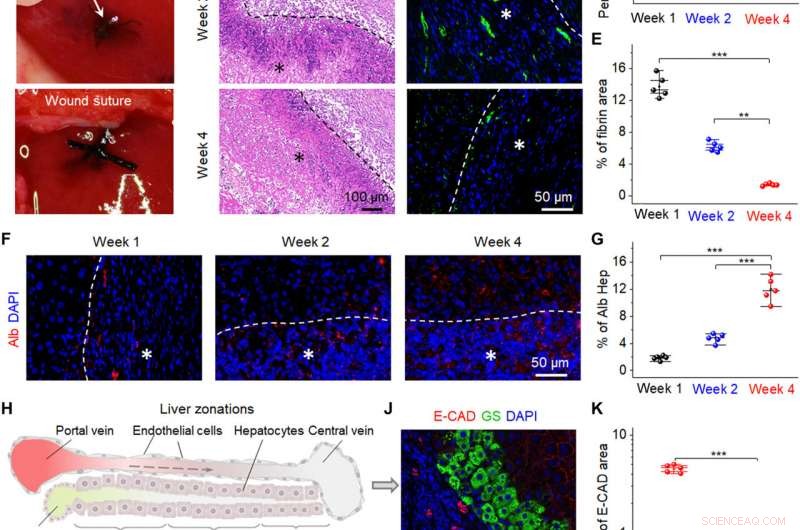
Promoção da reparação do fígado por bio-NGs in vivo. (A) Imagens cirúrgicas que mostram a implantação dos bio-NGs no defeito do fígado. (B) Coloração H&E das seções de fígado em diferentes pontos de tempo (semanas 1, 2, e 4) após a implantação. (C) Imagens representativas de imunocoloração de fibrina hepática (ogen) (verde) em 4 ′, 6-diamidino-2-fenilindol (DAPI) (azul) - seções de fígado contrastadas na área implantada. (D) Porcentagem média da área positiva medida a partir da coloração H&E. (E) Quantificação da marcação imunofluorescente da fibrina hepática. (F) Imunocoloração para Alb (vermelho) em seções de fígado em diferentes pontos de tempo (semanas 1, 2, e 4) após a implantação. (G) Nível de expressão de Alb medido a partir de imunocoloração de Alb. (H) Esquema mostrando três zonas do fígado da região periportal à pericentral. 1, 2, e 3 indicam zona 1 (E-CAD +), zona 2 (E-CAD─GS─), e zona 3 (GS +), respectivamente. A seta tracejada indica o fluxo sanguíneo. (I e J) Imunocoloração para GS (verde) e E-CAD (vermelho) em seções de fígado na quarta semana após a implantação. (K) Quantificação de GS e E-CAD mostrando expressão mais forte da função hepática de novos hepatócitos em bio-NGs do que de fibras 3D. Hep, hepatocito. Os asteriscos (*) mostram os locais da implantação. Os dados são expressos como valores médios ± DP. n =5. ** P <0,01 e *** P <0,001. Crédito da foto:Fei Jin, Universidade de Ciência e Tecnologia de Nanjing. Crédito:Science Advances, 10.1126 / sciadv.abh2350
Os cientistas então implantaram os bio-NGs em uma área de lesão hepática relativa à regeneração de hepatócitos para refletir sua praticidade. Para conseguir isso, eles usaram ratos Sprague-Dawley para induzir lesão hepática. Após quatro semanas de implantação dos bio-NGs, a equipe removeu os implantes e estudou a inflamação usando coloração histológica. Eles notaram uma inflamação leve na primeira semana, que melhorou na segunda semana e reduziu aos níveis normais na quarta semana. Todos os outros órgãos não mostraram deformação ou invasão de células linfáticas anormais para indicar boas condições de saúde sem efeitos colaterais sistemáticos. O processo regenerativo observado destacou um novo sistema de circulação sanguínea que se formou dentro do tecido hepático regenerado para sugerir a interação dos bio-NGs com as células para reduzir a inflamação e promover a reparação do tecido.
Estabilidade de longo prazo e biocompatibilidade de bio-NGs in vivo
A interação NG-célula promoveu de forma eficiente a viabilidade celular e manteve sua expressão funcional in vitro e in vivo para fornecer uma estratégia de tratamento para ensaios clínicos. Para regeneração de tecidos, é mais eficaz transplantar diretamente células funcionais para o local danificado in vivo. Para estudos adicionais, a equipe implantou os bio-NGs na área do músculo gastrocnêmio ao redor do nervo ciático de ratos para detectar a estabilidade dos bio-NGs in vivo. Li et al. em seguida, removeu os implantes após oito semanas e analisou a inflamação para mostrar boa biocompatibilidade de bio-NGs por períodos prolongados de tempo em ambientes biológicos sem quaisquer efeitos colaterais sistêmicos. As construções são promissoras como implantes para reparo regenerativo in vivo.
Estabilidade in vivo e biocompatibilidade de bio-NGs. Imagem cirúrgica que mostra a implantação dos bio-NGs nas áreas do músculo gastrocnêmio (A) e do nervo ciático (B) de um camundongo. (C) Coloração tricrômica de Masson dos músculos gastrocnêmios na área implantada. (D) Coloração imunofluorescente com TNF-α do nervo ciático na área implantada. (E) Porcentagem média de fibras de colágeno no tecido muscular medida a partir da coloração de Masson. (F) Nível de expressão de TNF-α relativo medido a partir de coloração por imunofluorescência de TNF-α. (G) Coloração H&E de órgãos vitais (fígado, coração, pulmão, rim, e cérebro) na semana 8 após a implantação na área do nervo ciático. Os dados são expressos como valores médios ± DP. n =5. *** P <0,001. Crédito da foto:Tong Li, Universidade de Ciência e Tecnologia de Nanjing. Crédito:Science Advances, 10.1126 / sciadv.abh2350 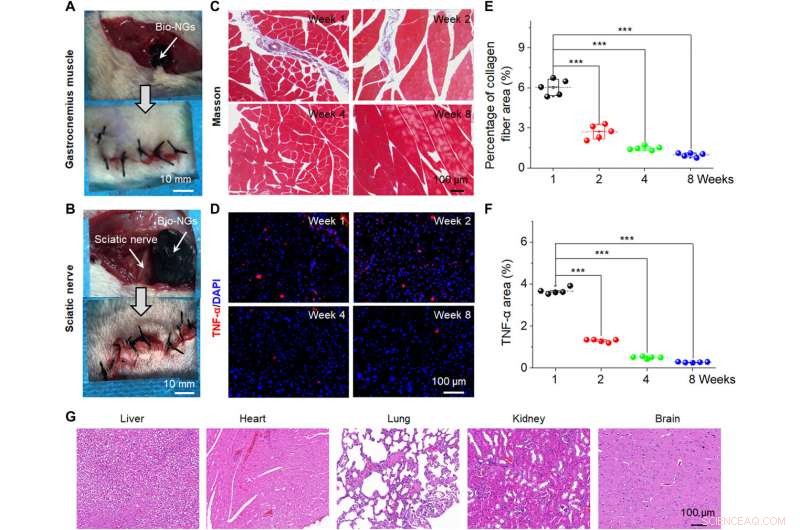
Desta maneira, Tong Li e seus colegas desenvolveram bio-nanogeradores de acoplamento eletromecânico tipo matriz extracelular (bio-NGs) para regular a atividade celular e manter sua expressão funcional específica. The product created a local voltage potential to stimulate living cells as long as they remained motile. The unique environment facilitated cell culture in bio-NGs to trigger the opening of ion channels present in the cellular plasma membrane to achieve electrical stimulation at the single-cell level. The process offers great potential for bioelectronic medicine and cell-targeted local electrical impulses. The new method can replace inaccurate 2D systems and time-consuming animal models to provide a biomimetic, physiological microenvironment for accelerated tissue regeneration and bioinspired electronic medicine.
© 2021 Science X Network