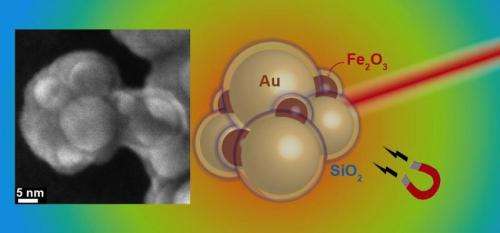
Esquema de agregados de óxido de ouro e ferro com casca de sílica. Esquerda:imagem microscópica eletrônica de um agregado. Crédito:Georgios Sotiriou / ETH Zürich
As nanopartículas têm um grande potencial na medicina:para diagnósticos, como um veículo para substâncias ativas ou uma ferramenta para matar tumores usando o calor. Os pesquisadores da ETH Zurich desenvolveram partículas que são relativamente fáceis de produzir e têm uma ampla gama de aplicações.
Se você colocar sua mão sobre uma tocha ligada no escuro, parece brilhar em vermelho. Isso ocorre porque os feixes de luz vermelha de comprimento de onda longo penetram no tecido humano de forma mais eficaz do que a luz azul de comprimento de onda curto. Os pesquisadores da ETH Zurich exploram esse fato em um novo tipo de nanopartículas:as chamadas partículas plasmônicas, que aquecem quando absorvem luz infravermelha. Isso pode permitir que eles matem o tecido tumoral com calor, por exemplo.
O ouro é um material popular para nanopartículas usadas terapeuticamente, pois é bem tolerado e geralmente não desencadeia reações indesejáveis. Na forma de bola ou esfera característica das nanopartículas, Contudo, o ouro não tem as propriedades necessárias para funcionar como uma partícula plasmônica que absorve o suficiente no espectro infravermelho próximo da luz para aquecer. Para fazer isso, precisa ser moldado em um formato especial, como uma haste ou concha, para que os átomos de ouro adotem uma configuração que começa a absorver luz infravermelha próxima, gerando assim calor. A produção de tais nanobastões ou nanoconchas em quantidades suficientes, Contudo, é complexo e caro.
Agregados em vez de hastes
Uma equipe de pesquisadores liderada por Sotiris Pratsinis, Professor de Tecnologia de Partículas na ETH Zurique, agora descobriu um truque para fabricar partículas de ouro plasmônico em grandes quantidades. Eles usaram seu know-how existente em nanopartículas plasmônicas e fizeram nanopartículas de ouro em forma de esfera que exibem as propriedades plasmônicas do infravermelho próximo desejadas, permitindo que sejam agregadas. Cada partícula é previamente revestida com uma camada de dióxido de silício, que atua como um espaço reservado entre as esferas individuais no agregado. Através da distância precisamente definida entre várias partículas de ouro, os pesquisadores transformam as partículas em uma configuração que absorve luz infravermelha próxima e, portanto, gera calor.
“A casca de dióxido de silício tem outra vantagem”, explica Georgios Sotiriou, primeiro autor do estudo e, até recentemente, um pós-doutorado no grupo de pesquisa de Pratsinis e atualmente um membro da Swiss National Science Foundation na Universidade de Harvard:"Impede que as partículas se deformem quando aquecem." Este é um grande problema com os nanobastões. Se as hastes perderem a forma durante o aquecimento, eles perdem suas propriedades plasmônicas desejadas e não são mais capazes de absorver luz infravermelha próxima o suficiente para gerar calor.
Os pesquisadores já testaram as novas partículas em células de câncer de mama em uma placa de Petri e descobriram que, após a exposição à luz infravermelha próxima, as nanopartículas aqueciam o suficiente para matar as células, enquanto as células sobreviveram em experimentos de controle (com partículas, mas sem radiação e com radiação, mas sem nanopartículas).
Combinação com grande potencial
Para ser capaz de direcionar as partículas especificamente para o tecido canceroso, os pesquisadores também misturaram partículas de óxido de ferro superparamagnéticas com as partículas de ouro, que permitem que os nanoagregados sejam controlados por meio de campos magnéticos e podem aumentar sua acumulação em um tumor. Além disso, isso abre a possibilidade de aquecer os agregados em camadas profundas de tecido que a luz infravermelha não pode mais atingir por meio da hipertermia magnética. Aqui, o aquecimento das partículas é induzido por um campo magnético, onde os pólos positivo e negativo alternam em uma taxa rápida.
"Muitas perguntas ainda precisam ser respondidas antes que as partículas possam ser usadas em humanos", disse Jean-Christophe Leroux, Professor de Formulação e Entrega de Medicamentos na ETH Zurique, que também esteve envolvido no projeto de pesquisa. Embora ouro, dióxido de silício e óxido de ferro são bem tolerados, o que acontece com os agregados de partículas no corpo ao longo do tempo - se eles se acumulam no fígado ou são decompostos e excretados, por exemplo - ainda precisa ser investigado.
As nanopartículas híbridas de óxido de ferro-ouro não são apenas capazes de matar células tumorais por meio do calor; eles também podem ser usados como meio de contraste para processos de imagem em diagnósticos por imagem de ressonância magnética, conforme investigado em colaboração com o University Hospital Zurich, ou como parte de um veículo que transporta substâncias ativas. "Você pode até mesmo acoplar as partículas a portadores de drogas sensíveis à temperatura, que permitiria a liberação do medicamento caso uma determinada temperatura fosse ultrapassada ", explica Sotiriou. Isso permitiria que efeitos colaterais indesejáveis no resto do corpo fossem reduzidos ou mesmo evitados.