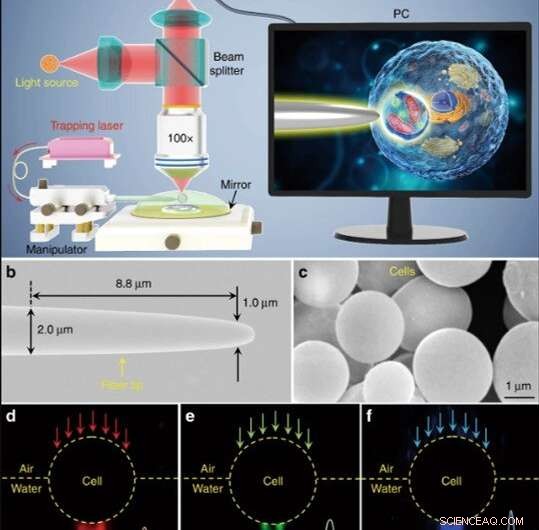
Ilustração esquemática e caracterização do material. (a) Ilustração esquemática da configuração experimental. Um microscópio de modo de reflexão convencional equipado com uma câmera CCD e lente objetiva × 100 foi usado para observar as amostras e registrar as imagens. A inserção mostrada em uma tela de PC que descreve esquematicamente como o biomagnificador é usado para ampliar e criar imagens das estruturas subcelulares dentro de uma amostra biológica. (b) Imagem SEM da ponta da fibra com um diâmetro de 1,0 μm em sua extremidade cônica. (c) Imagem SEM mostrando biomagnificadores baseados em células de levedura com superfícies lisas e formas esféricas. Imagens de campo escuro d-f mostrando luz vermelha de 644 nm (d), Luz verde de 532 nm (e), e luz azul de 473 nm (f) transmitindo através do biomagnificador e sendo focada em pontos de luz abaixo do comprimento de onda com raios de cintura de 370, 300, e 270 nm, respectivamente. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4
Microscópios ópticos e pinças podem criar imagens e manipular objetos em microescala para aplicações em biologia celular e molecular. A resolução óptica é, Contudo, dificultado pelo limite de difração e, portanto, microscópios e pinças são incapazes de criar imagens e manipular nanoobjetos diretamente. Técnicas emergentes em nanoscópios plasmonic / fotônicos e nanotweezers visam alcançar resolução em escala nanométrica, embora as estruturas de material de alto índice possam facilmente causar danos mecânicos e fototérmicos aos bioespécimes em nanoescala.
Em um estudo recente agora publicado em Light:Ciência e Aplicações , Yuchao Li e colegas do Instituto de Nanofotônica da China, desenvolveu um sistema de microscópio óptico usando células vivas como lentes minúsculas para gerar imagens e manipular objetos menores que o comprimento de onda da luz. Eles mostraram imagens de limite de sub-difração e manipulação de nanoobjetos com um dispositivo não invasivo, que eles construíram prendendo uma célula em uma ponta de fibra. A célula presa formou um biomagnificador que poderia ampliar nanoestruturas com uma resolução de 100 nm, sob microscopia de luz branca. Usando o biomagnificador, Li et al. formou uma armadilha nano-óptica para manipular com precisão uma nanopartícula individual com um raio de 50 nm. A técnica fornece uma ferramenta de alta precisão para imagens ópticas, detecção e montagem de bio-nanomateriais sem danos mecânicos ou fototérmicos.
A imagem óptica para manipular pequenos objetos é crucial para o diagnóstico médico, sensoriamento biológico, exploração celular, treinamento molecular e montagem de materiais. Pinças e microscópios são dispositivos padrão para imagens sem contato e manipulação de amostras minúsculas que variam de alguns nanômetros a vários mícrons. No entanto, é um desafio usar a tecnologia para gerar imagens em nanoescala, uma vez que a resolução óptica é restrita a aproximadamente metade do comprimento de onda de iluminação.
Os cientistas alcançaram um progresso dramático de nanoscópios de campo próximo e nanotweezers nas últimas décadas para obter imagens ópticas com resolução nanométrica. Essas técnicas de imagem foram impedidas por materiais inorgânicos de alto índice, como metais nobres e semicondutores usados para sua fabricação - que podem danificar mecanicamente amostras de células biológicas ou tecido durante a imagem e manipulação de campo próximo.
Os cientistas, portanto, investigaram esquemas de imagem ótica mais simples baseados em microesferas dielétricas para superar o limite de difração comum aos microscópios convencionais. Embora a técnica não tenha rótulos e seja viável, tais microesferas são baseadas em materiais inorgânicos artificiais, como dióxido de silício (SiO 2 ), dióxido de titânio (TiO 2 ) e titanato de bário (BaTiO 3 ) Os pesquisadores estão, portanto, interessados em desenvolver um biomaterial natural para construir um dispositivo biocompatível para bioimagem, manipulação e biomagnificação em resolução espacial em nanoescala.
(a) Ilustração esquemática da configuração experimental. Um microscópio de modo de reflexão convencional equipado com uma câmera CCD e lente objetiva × 100 foi usado para observar as amostras e registrar as imagens. A inserção mostrada em uma tela de PC que descreve esquematicamente como o biomagnificador é usado para ampliar e criar imagens das estruturas subcelulares dentro de uma amostra biológica. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 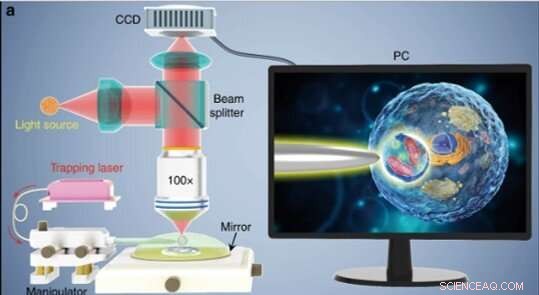
Os cientistas conduziram todos os experimentos sob um microscópio óptico de modo de reflexão acoplado a uma câmera de dispositivo de carga acoplada (CCD) e lentes objetivas. Eles usaram fontes de luz em 390 nm, 560 nm e 808 nm para excitação, iluminação e captura respectivamente. Usando uma fibra óptica com uma ponta cônica, Li et al. prendeu o biomagnificador na extremidade da fibra, que eles controlavam movendo a ponta usando um micromanipulador. Li et al. selecionou células lisas e esféricas para minimizar a aberração de imagem e observou as células para exibir melhor desempenho de foco quando semi-imersas em solução para manter a viabilidade celular.
Desempenho de imagem experimental de diferentes biomagnificadores. (a) Diagrama esquemático mostrando que o biomagnificador coleta as nanoestruturas de campo próximo de um objeto e forma uma imagem virtualmente ampliada que pode ser capturada por um microscópio óptico convencional. (b – e) Imagens ópticas de diferentes biomagnificadores construídos a partir de bactérias (b), levedura (c), sangue vermelho (d), e células-tronco (e) que estão parcialmente submersas em suspensão celular. f Imagem SEM de um arranjo de nanosfera hexagonal de sílica compactado bidimensional montado por uma técnica de fotoforese. (g – j) Imagens ópticas da matriz de nanosfera de sílica ampliada por meio de biomagnificadores baseados em bactérias (g), fermento (h), sangue vermelho (i), e células-tronco (j). (k) Imagem SEM da superfície de uma grade de disco Blu-ray com uma largura de linha de 200 nm e espaçamento de 100 nm. l – o Imagens ópticas da estrutura da grade do Blu-ray ampliadas por meio de biomagnificadores baseados em bactérias (l), fermento (m), sangue vermelho (n), e células-tronco (o). p Perfil de intensidade ao longo da linha pontilhada na estrutura de grade de Blu-ray indicada em o. q Pontos azuis mostrando o fator de ampliação M das imagens obtidas pelos biomagnificadores em função do diâmetro do biomagnificador. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 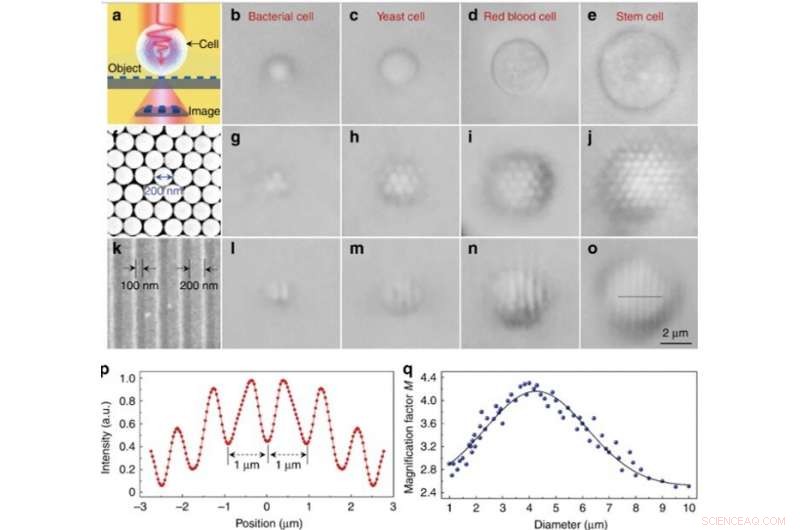
Apenas nanoesferas com biomagnificadores em cima delas puderam ser resolvidas durante a imagem, enquanto as nanoesferas sem biomagnificadores não puderam ser resolvidas usando um microscópio convencional. O fator de ampliação M dos biomagnificadores baseados em células-tronco foi determinado ser 3,3 vezes maior (x3,3), e os cientistas mostraram que o M experimental dependia do diâmetro do biomagnificador. Subseqüentemente, Li et al. realizaram todos os experimentos usando biomagnificadores deste diâmetro.
Imagem nano-óptica de estruturas subcelulares e letras nanopadronizadas. (uma, b) Imagens ópticas das estruturas subcelulares de uma célula epitelial humana usando um microscópio óptico convencional (a) e biomagnificadores (b). As posições de quatro biomagnificadores são marcadas como A – D. Para comparação, os biomagnificadores podem resolver o citoesqueleto fibroso (indicado como A – C) dentro da célula e estruturas de duas camadas (indicadas como D) na membrana celular, que são indistinguíveis ao microscópio convencional. c – e SEM (c), campo escuro (d), e imagens ópticas (e) de letras nanopatternadas JNU representando a sigla de Jinan University. A largura da linha das letras nanopadronizadas é 100 nm, que é menor do que a resolução do limite de difração do microscópio óptico convencional. f – h Imagens ópticas mostrando que o biomagnificador preso na ponta da fibra pode digitalizar e gerar imagens das letras J (f) nanopadrão, N (g), e U (h) movendo a fibra. A largura da linha das letras nanopadronizadas foi ampliada de 100 a 400 nm. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4 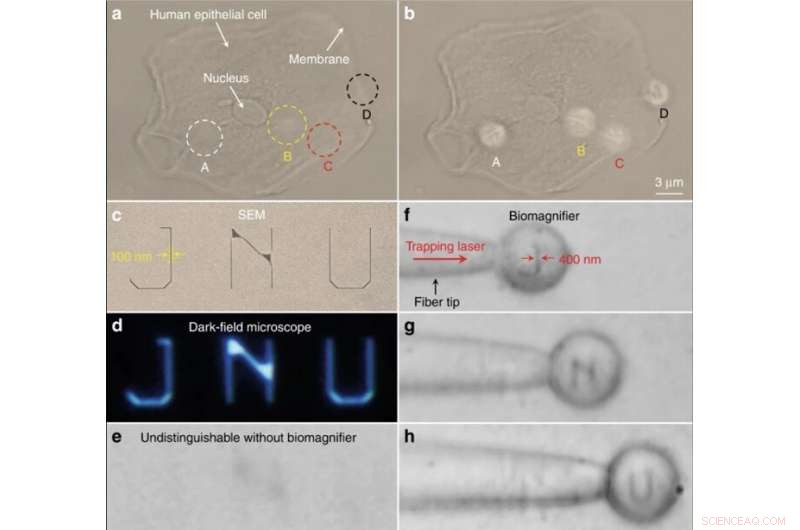
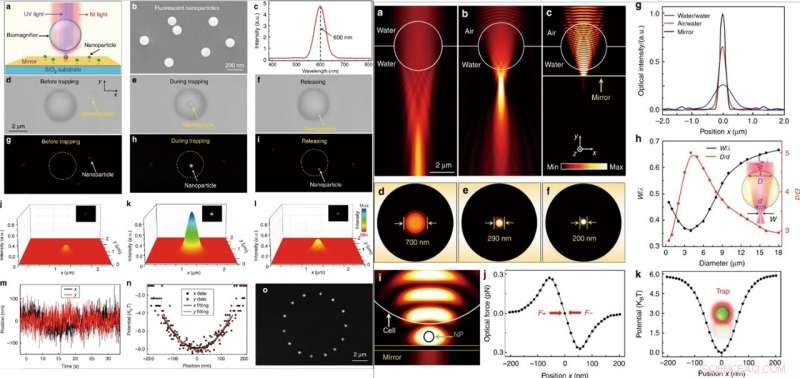
ESQUERDA:Manipulação óptica de uma única nanopartícula fluorescente. (a) Diagrama esquemático mostrando uma nanopartícula fluorescente suspensa na superfície de um espelho e presa pelo biomagnificador. (b) Imagem SEM mostrando as nanopartículas fluorescentes de PS com um raio médio de 50 nm. (c) Espectro de emissão mostrando o comprimento de onda de emissão central das nanopartículas fluorescentes localizadas a 600 nm. (d – f) Imagens ópticas mostram o processo de captura de uma única nanopartícula de PS com o biomagnificador. O processo consistia em três etapas sucessivas:antes da captura (d), durante a captura (e), e após a liberação (f). g – i Imagens de fluorescência mostrando o ponto de fluorescência da nanopartícula de PS antes de ser capturada (g), durante a captura (h), e após a liberação (i). j – l Mapeamento tridimensional de cores dos pontos de fluorescência da nanopartícula como mostrado em g – i. m Traço em tempo real da posição da nanopartícula presa nas direções xey. (n) Potencial de aprisionamento da nanopartícula presa nas direções xey com acessórios de parábola. (o) Imagens compostas de fluorescência mostram o traço de movimento da nanopartícula presa no plano x – y por movimento controlado do biomagnificador. À DIREITA:Simulação numérica e cálculo. (a – c) Distribuições de intensidade óptica de luz focando por um biomagnificador de 4 μm totalmente imerso em água (a), semi-imerso em água (b), e suspenso na superfície de um espelho (c). A fonte de luz de iluminação foi definida como um feixe gaussiano com comprimento de onda de 560 nm. (d – f) Distribuições de intensidade óptica dos pontos de luz do biomagnificador correspondentes a (a – c) no plano x – z. (g) Perfis de intensidade óptica nos planos focais da luz de saída dos biomagnificadores na direção x. (h) Resultados da simulação de FEM para a cintura normalizada do ponto de luz w / λ (w é o raio da cintura do ponto de luz e λ é o comprimento de onda da luz de entrada) e a razão D / d (a largura da região linear onde a luz entra no biomagnificador em sua superfície frontal é referido como D, e a largura do feixe de luz de saída na superfície traseira é (d) em função do diâmetro do biomagnificador. (i) Distribuição de intensidade simulada de luz de captura no infravermelho próximo mostrando que uma nanopartícula (raio:50 nm) está presa na lacuna entre o biomagnificador e o espelho. A potência óptica de entrada da luz de captura foi definida para 10 mW. (j) Forças ópticas simuladas da nanopartícula presa no ponto de luz em função da posição da nanopartícula ao longo da direção x. (k) Potencial de captura calculado da nanopartícula capturada em função da posição ao longo da direção x. Crédito:Light:Science &Applications, doi:10.1038 / s41377-019-0168-4
Depois disso, quando eles irradiaram simultaneamente raios infravermelhos próximos (IR) e raios ultravioleta no biomagnificador através de uma lente objetiva, eles poderiam capturar e excitar as nanopartículas. Para esses experimentos, os cientistas usaram nanopartículas fluorescentes com um raio médio de 50 nm. Quando eles prendem uma única nanopartícula no foco de um biomagnificador, eles observaram imagens ópticas e fluorescentes da amostra de interesse. Li et al. em seguida, calculou a rigidez de aprisionamento da partícula em tempo real usando uma pinça óptica padrão. A capacidade de manipular uma única nanopartícula sem contato e com precisão via óptica será útil para montar nanoestruturas bem reguladas. Quando Li et al. investigou numericamente o mecanismo de imagem e a rigidez de captura de biomagnificadores usando simulação 3-D e software COMSOL. Eles observaram a capacidade de focalização de luz com limite de subdifração resultante de um efeito combinado de "nanojato fotônico" e aumento de interferência coerente pelo espelho.
As limitações do método incluíram aberração e distorção de imagem devido às estruturas intracelulares não homogêneas do biomagnificador natural, em comparação com microesferas dielétricas com índices de refração uniformes. Felizmente, os materiais intracelulares eram opticamente transparentes à luz visível e infravermelha próxima e as interações ópticas eram relativamente fracas dentro de uma única célula. As atividades intracelulares também podem alterar a distribuição parcial do índice de refração em uma célula para causar distorção da luz durante o aprisionamento e a imagem, mas a maioria das atividades intracelulares foi ultra-rápida e não influenciou o esquema de imagem.
Desta maneira, Yuchao Li e colegas desenvolveram uma nova técnica de imagem experimental e verificaram as capacidades experimentais com simulações FEM. Li et al. nanoscópios ópticos integrados e nanotweezers em um único dispositivo para gerar imagens e manipular nanoestruturas simultaneamente pela primeira vez no presente trabalho. Eles promoveram a resolução da técnica para 100 nm e propuseram um procedimento de imagem livre de rótulos. Os cientistas imaginam o biomagnificador vivo para abrir novas oportunidades em imagens de super-resolução, detecção em tempo real e nano-montagem precisa de bionanomateriais para formar nanoarquiteturas de interesse.
© 2019 Science X Network