Novo método usa luz para permitir a geração de aminoácidos não canônicos
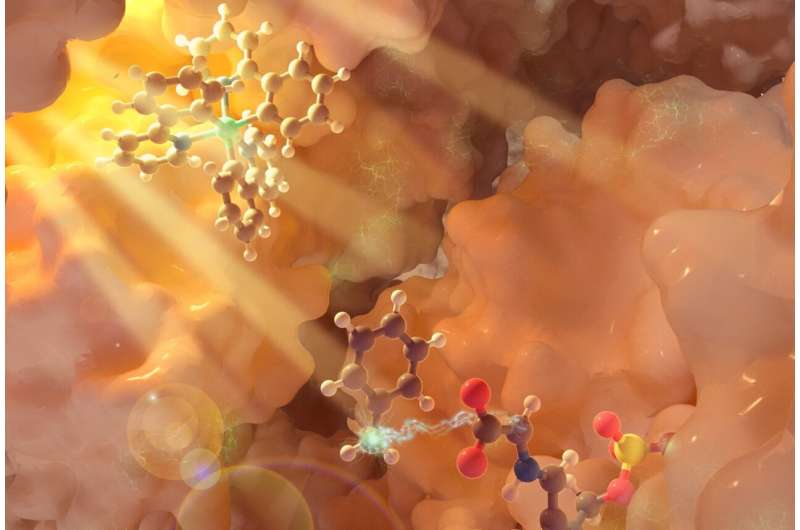 Crédito:Universidade da Califórnia - Santa Bárbara
Crédito:Universidade da Califórnia - Santa Bárbara
Os pesquisadores da UC Santa Barbara estão construindo o repertório de reações químicas usando luz. Em artigo publicado na revista Nature , o professor de química Yang Yang e colaboradores da Universidade de Pittsburgh relatam um método que usa fotobiocatálise para produzir aminoácidos não canônicos (que não ocorrem naturalmente) que são blocos de construção valiosos da terapêutica peptídica, produtos naturais bioativos e novas proteínas funcionais.
