
Foto dos pesquisadores, apresentando (da esquerda para a direita):Dr. Hen Dotan, Avigail Landman, Prof. Avner Rothschild, Prof. Gideon Grader. Crédito:Chen Galili, Departamento de Porta-vozes Technion.
A produção de hidrogênio eletrolítico envolve a geração de hidrogênio a partir da água usando energia elétrica, que deve vir de fontes de energia renováveis, como luz solar e vento. Embora este método de produção de hidrogênio possa ser uma solução muito promissora para aumentar a sustentabilidade, mas os pesquisadores terão que superar vários desafios importantes para que se torne generalizado.
Em um estudo recente apresentado em Nature Energy , uma equipe de pesquisadores do Instituto de Tecnologia Technion-Israel abordou alguns desses desafios, apresentando uma nova técnica para divisão de água que poderia aprimorar os métodos de produção de hidrogênio eletrolítico existentes. Sua pesquisa se inspira em um de seus estudos anteriores sobre divisão de água fotoeletroquímica (PEC), em que tentaram combinar energia solar e água (foto) eletrólise para gerar hidrogênio a partir da luz solar e da água.
Um dos maiores desafios delineados neste trabalho anterior foi a coleta de gás hidrogênio de milhões de células PEC distribuídas no campo solar. Em seu estudo, os pesquisadores baseados no Technion tentaram desenvolver uma técnica que pudesse enfrentar com eficácia esse desafio.
"Tomando plantas solares fotovoltaicas (PV) como cenário base, o parque solar é composto por milhões de células FV individuais, onde a corrente (e voltagem) é coletada de cada um deles em uma grade de metal, "Avner Rothschild, um dos pesquisadores que realizou o estudo, disse TechXplore. "Isso é fácil com eletricidade, mas não é assim com o gás hidrogênio. "
Em uma planta solar PEC ideal do futuro, As células PV seriam substituídas por células PEC, que pode produzir hidrogênio em um componente conhecido como compartimento catódico, e oxigênio em uma câmara separada chamada de compartimento anódico. Esses dois compartimentos devem ser separados, pelo menos por uma membrana, a fim de garantir que o hidrogênio e o oxigênio não se misturem, pois isso causaria uma explosão. Além disso, o gás hidrogênio deve ser coletado de cada célula individual.
A criação desta configuração até agora provou ser tecnicamente difícil e cara, pois requer um coletor de tubulação muito caro. Em última análise, isso tornou irrealista a realização de soluções para a produção de hidrogênio em grande escala pela separação da água do PEC.
“Buscamos uma saída para este desafio, e teve a ideia de separar os compartimentos de oxigênio e hidrogênio na célula PEC em duas células separadas, para que o oxigênio seja gerado no campo solar e liberado para a atmosfera, enquanto o hidrogênio é gerado em um reator central no canto do campo, "Rothschild disse." A separação em duas células é possível inserindo outro conjunto de dois eletrodos, chamados eletrodos auxiliares, que estão sendo carregados e descarregados simultaneamente pelo OH - íons envolvidos na reação de divisão da água, mediando assim a troca iônica entre as duas células (que é necessária para fechar o circuito elétrico). "
Em seu artigo anterior, publicado em Materiais da Natureza , Rothschild e seus colegas apresentaram uma nova abordagem disruptiva para arquiteturas de eletrólise de água (eletrolisadores) e fotoeletrólise (PEC). Esta abordagem promissora, Contudo, introduziu outro desafio de regenerar os eletrodos auxiliares quando eles ficam saturados no final de um ciclo de produção. Os pesquisadores sugeriram que os eletrodos poderiam ser trocados no final de cada ciclo, mas isso seria bastante complicado, então eles continuaram explorando soluções alternativas.
"Descobrimos então que, quando você aquece o eletrodo auxiliar na célula de hidrogênio, depois de ser carregado (para se tornar NiOOH), ele libera bolhas de gás oxigênio espontaneamente e se regenera ao seu estado inicial (Ni (OH) 2 ), "Rothschild disse." Esta descoberta levou ao desenvolvimento do processo de divisão de água E-TAC que é apresentado neste trabalho. "
E-TAC, a nova técnica de divisão da água proposta por Rothschild e seus colegas, tem uma alta eficiência energética de 98,7 por cento, portanto, supera significativamente os eletrolisadores convencionais, que normalmente têm uma eficiência energética de ~ 70 a 80 por cento para dispositivos de última geração. Uma outra vantagem do E-TAC é que ele produz hidrogênio e oxigênio sequencialmente, enquanto na maioria dos outros eletrolisadores, eles são produzidos simultaneamente. Em última análise, isso remove a necessidade de uma membrana separando os gases hidrogênio e oxigênio, assim, simplificando muito a construção e montagem das células, bem como sua operação e manutenção.
"Potencialmente, isso pode se traduzir em uma grande economia em custos de capital e operação, levando ao desenvolvimento de tecnologia econômica de divisão de água que pode competir com SMR (reforma de metano a vapor), oferecendo hidrogênio barato sem CO 2 emissões, desde que a eletricidade venha de fontes renováveis, como energia hidrelétrica, energia solar ou eólica, "Rothschild disse.
Na eletrólise de água convencional, hidrogênio e oxigênio são sempre produzidos simultaneamente nos compartimentos cátodo e ânodo, respectivamente. Os compartimentos são colocados o mais próximos possível uns dos outros, para minimizar as perdas ôhmicas elétricas, e eles são separados por uma membrana para evitar a criação de um explosivo H 2 / O 2 mistura.
“O cátodo reduz a água, gerando hidrogênio (H 2 moléculas) e íons hidróxido (OH - ) por meio de uma reação conhecida como HER (reação de evolução de hidrogênio), "Rothschild disse." O OH - os íons migram para o ânodo através do eletrólito e através da membrana, onde eles são oxidados através do OER (reação de evolução de oxigênio). Juntos, essas duas reações (HER e OER) completam a reação de divisão da água:2H 2 O 2H 2 + O 2 . "
Na eletrólise de água convencional, as duas reações eletroquímicas descritas por Rothschild são acopladas no tempo e no espaço, à medida que ocorrem simultaneamente, na mesma cela e nas proximidades. Além disso, essas características são as mesmas se o processo for aplicado a eletrolisadores alcalinos ou PEM.
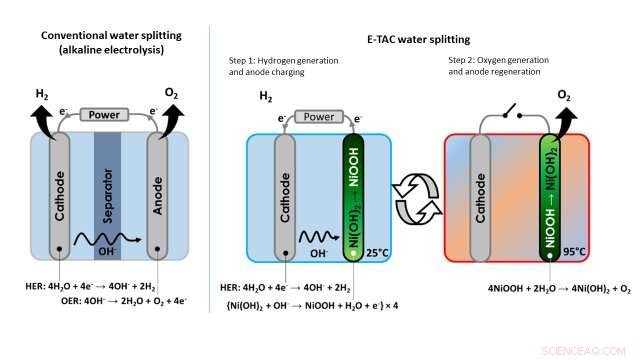
Imagem mostrando a diferença entre a abordagem convencional de separação da água (eletrólise alcalina) e a técnica de separação da água E-TAC proposta pelos pesquisadores. Crédito:Dotan et al.
Ao contrário desta abordagem tradicional para eletrólise da água, o processo de divisão da água idealizado pelos pesquisadores desacopla as reações HER e OER, que, em vez disso, ocorrem em momentos diferentes e potencialmente em diferentes partes de um dispositivo. Em vez de ser contínuo, Portanto, E-TAC pode ser descrito como um 'processo em lote' com dois ciclos, o primeiro gerando hidrogênio eletroquimicamente e o segundo oxigênio por meio de uma reação química espontânea.
“Colocamos o cátodo (o mesmo cátodo usado na eletrólise alcalina) e o ânodo (que é diferente do ânodo na eletrólise convencional) em uma célula eletrolítica e passamos a corrente entre eles, "Rothschild disse." O cátodo gera hidrogênio por meio da reação HER, assim como no caso de eletrólise de água convencional, mas o ânodo faz uma coisa completamente diferente. O ânodo é essencialmente carregado absorvendo o OH - íons que são gerados no cátodo, e transformar gradualmente de Ni (OH) 2 (hidróxido de níquel) para NiOOH (oxihidróxido de níquel). "
Interessantemente, a reação produzida no ânodo é a mesma que ocorre no cátodo das baterias alcalinas (por exemplo, baterias Ni-MH) durante o carregamento. Isso sugere que pode funcionar bem por muitos ciclos, assim como acontece com as baterias alcalinas.
As vezes, Contudo, o carregamento do ânodo no processo E-TAC precisa ser interrompido, porque se for sobrecarregado, ele poderia começar a gerar oxigênio. Quando a carga ultrapassa um certo nível, Portanto, os pesquisadores precisam limitar a voltagem aplicada às células para evitar possíveis explosões derivadas da cogeração de oxigênio e hidrogênio.
"Para continuar o processo E-TAC, então precisamos regenerar o ânodo carregado (NiOOH) de volta ao seu estado inicial (Ni (OH) 2 ), "Rothschild explicou." Fazemos isso aumentando sua temperatura, acelerando assim a taxa da reação química espontânea entre o ânodo carregado e a água, which releases oxygen and regenerates the anode back to its initial state."
The technique devised by Rothschild and his colleagues thus entails the use of heat to control the chemical reaction that generates oxygen, as the rate of the reaction slows down at low temperatures and accelerates at high temperatures. The generation of hydrogen occurs at a low or ambient temperature, and the generation of oxygen at high temperatures around 95 degrees Celsius. This is why the researchers decided to call it the E-TAC process, which stands for electrochemical-thermally activated chemical process.
"In the proof-of-concept lab tests presented in our article, we manually moved the anode from the cold cell (i.e. a glass beaker filled with alkaline aqueous solution at ambient temperature) to the hot cell (i.e. the same type of beaker, but heated to 95 degrees Celsius), so the separation between hydrogen and oxygen generation was not only in time but also in place, " Rothschild explained. "However, in a real-world industrial system, we foresee a different scenario in which the two electrodes (anode and cathode) and stationary (not moving), whereas the cell in which they are is filled sequentially with cold or hot electrolyte solutions."
Separating the production of hydrogen and oxygen, which removes the need for a membrane separating the two different chambers inside electrolytic cells, results in substantial savings over traditional electrolysis approaches. Na verdade, sealing the membrane is generally expensive and also complicates the overall production process. The membrane in conventional systems requires high-purity water and ongoing maintenance, all of which are unnecessary in E-TAC.
Além disso, the technique devised by Rothschild and his colleagues entirely eliminates the risk of volatile encounters between oxygen and hydrogen, as well as resulting explosions. In traditional systems, por outro lado, this risk is still present, as the membrane could rip or its seal could break.
"Atualmente, the use of membranes also limits the pressure in hydrogen production, " Rothschild said. "E-TAC renders the membrane unnecessary, thus facilitating hydrogen production under much higher pressure and eliminating some of the high costs of compressing the hydrogen later. Além disso, in the new process we proposed, oxygen is produced via a spontaneous chemical reaction between the charged anode and the water, without using an electrical current. This reaction eliminates the need for electricity during oxygen production and increases energetic efficiency from ~70 to 80 percent using customary methods to an unprecedented 98.7 percent."
The technique developed by Rothschild and his colleagues could lower operating costs of sustainable hydrogen production and equipment costs. The researchers have estimated that the production costs for equipment based on E-TAC would be approximately half of those for existing technologies.
"The process we invented presents a conceptual breakthrough in water splitting, and in view of the advantages it offers, it may become a game-changer and lead to a new technology for hydrogen production from water without CO 2 emissions, which could compete with SMR to produce clean hydrogen and enable the transition from fossil fuels to clean hydrogen fuel, " Rothschild said.
After they finished writing their paper, the researchers at Technion patented their invention and founded a start-up called H 2 Pro, with the mission of developing and distributing new water splitting technology based on the E-TAC technique. They hope to soon commercialize this technology by scaling-up the electrodes and cells used in their study, constructing and testing hydrogen generators based on the E-TAC water-splitting process, optimizing their operation scheme and examining high-pressure hydrogen production.
"We also plan to carry out further academic research to study new electrode materials and apply advanced analytical methods to understand the correlations between electrode composition and microstructure and its function properties, in order to develop the next generation of Ni(OH) 2 -based electrodes for our E-TAC water-splitting process, " Rothschild said. "Our goal is to improve their capacity (so that we can run longer processes) with fast charging and regeneration rates to enable high hydrogen production rates."
© 2019 Science X Network