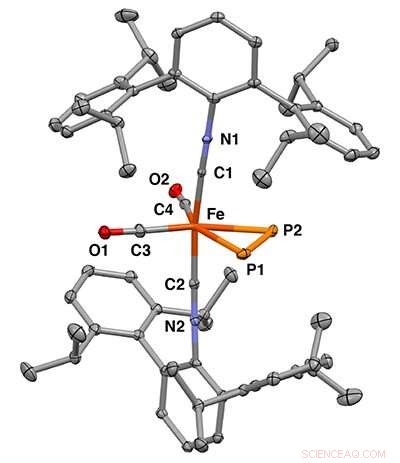
Estrutura cristalina de raios-X do complexo mononuclear de ferro η2-difósforo. Crédito:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University
Os elementos da tabela periódica de elementos são listados de forma a enfatizar certas relações. Existem famílias, períodos (as linhas horizontais) e grupos (as colunas verticais). Os elementos dentro de cada um desses agrupamentos exibem algumas semelhanças.
As relações diagonais na tabela periódica existem entre dois elementos em posições diagonais entre si que exibem propriedades químicas semelhantes. Lítio e magnésio, boro e silício e carbono e fósforo são todos exemplos.
Uma relação diagonal icônica tem sido reconhecida há muito tempo entre carbono e fósforo, especialmente nos casos em que a ligação múltipla elemento-elemento está presente, como o difósforo (P
2 ) em que dois átomos de fósforo são unidos por uma ligação tripla fraca.
Essa relação diagonal entre fósforo e carbono estabeleceu a expectativa de que a molécula de difósforo deve imitar os atributos do hidrocarboneto acetileno (C
2 H
2 ). Por exemplo, tanto o difósforo quanto o acetileno reagem com outras moléculas orgânicas por meio de suas ligações pi, um tipo de ligação covalente encontrada em moléculas com ligações múltiplas.
Um complexo de coordenação consiste em um átomo ou íon central que geralmente é metálico e é cercado por moléculas ou íons ligados, conhecidos como ligantes ou agentes complexantes. Os complexos de coordenação são vitais para a vida na Terra e incluem hemoglobina e clorofila. Eles também são amplamente utilizados em aplicações industriais como catalisadores.
Embora o acetileno tenha uma química de coordenação bem documentada com metais de transição únicos, os complexos de coordenação que apresentam difósforo ligado a um único centro metálico permaneceram indescritíveis.
Recentemente, pesquisadores da Universidade da Califórnia em San Diego, da Universidade de Rochester e da Universidade Estadual de Ohio relataram a ligação do difósforo a um único centro metálico. Este trabalho aparece na edição de 25 de março da
Science .
O difósforo – ao contrário do acetileno – é altamente instável e reativo. Quando gerado na forma livre, o difósforo polimeriza rapidamente ou reage com as moléculas de substrato que estão presentes. Em outras palavras, o difósforo não permanece difósforo por muito tempo - sua natureza é combinar com outros elementos e moléculas. Isso dificulta o estudo ou a manipulação.
Várias rotas sintéticas foram estabelecidas para formar complexos multinucleares de difósforo. O método mais popular é separar o tetraédrico P
4 molécula, mais comumente conhecido como fósforo branco. No entanto, o fósforo branco é tóxico e altamente inflamável (foi um componente principal em muitas bombas incendiárias usadas na Segunda Guerra Mundial).
"O trabalho apresentado aqui fornece uma estratégia sintética para acessar complexos mononucleares de difósforo em ambientes de laboratório", afirmou o professor de química e bioquímica da UC San Diego, Joshua Figueroa, investigador principal e co-autor do artigo. "Antecipamos que este modo de coordenação pode permitir ainda mais o desenvolvimento de reações seletivas de transferência de átomos de fósforo para moléculas orgânicas".
Ao projetar o experimento, Figueroa e o estudioso de pós-doutorado da UC San Diego, Shuai Wang, usaram o ferro como íon metálico porque fornecia uma boa plataforma de coordenação que permitia a ligação de pequenas moléculas de maneira eficiente. Ao ligar o difósforo a um íon de ferro, eles foram capazes de unir os dois átomos de fósforo de uma maneira que contornava a liberação livre de difósforo, proporcionando uma estabilidade muito procurada.
Wang, que é o primeiro autor do artigo e executou o trabalho sintético, disse:"Considerando a extrema sensibilidade da molécula de difósforo livre como uma espécie fugaz, é notável o quão estável ela se torna ao coordenar o centro de ferro mononuclear estericamente sobrecarregado. "
Os pesquisadores usaram cristalografia de raios-X para determinar a estrutura 3D precisa das moléculas e espectroscopia de Mossbauer para observar mudanças nas interações de ligação entre o íon de ferro e o difósforo. Esta foi uma técnica chave porque permitiu aos pesquisadores mostrar que o difósforo e uma molécula de acetileno influenciaram as propriedades do centro de ferro de maneiras semelhantes.
Se o difósforo puder existir em uma forma relativamente estável e seletivamente reativa, os cientistas poderão anexá-lo a substratos em algo conhecido como química de "clique". A química do clique não descreve uma única reação específica, mas descreve uma maneira de gerar substâncias juntando pequenas unidades modulares. Isso pode abrir novas áreas de descoberta em química sintética para a preparação de compostos farmacêuticos.
"Estamos entusiasmados com este trabalho porque demonstra a importância de usar conceitos fundamentais aprendidos no primeiro ano de química para orientar novas descobertas", disse Figueroa.
+ Explorar mais Novo íon aromático inorgânico
