Resumo gráfico. Crédito:Natureza Química (2022). DOI:10.1038/s41557-022-00937-w
A cada momento nas células do nosso corpo, ocorrem inúmeras atividades vitais para a vida graças às enzimas. Essas proteínas especiais atuam como catalisadores, acelerando o ritmo e melhorando a seletividade das reações químicas sem sofrerem mudanças permanentes. Além de seu papel indispensável na biologia, as enzimas também são críticas para inúmeros processos nas indústrias alimentícia, farmacêutica, agrícola e cosmética.
Desmentindo sua onipresença e importância, as enzimas são pouco compreendidas. Em particular, os cientistas querem saber o que torna os sítios ativos das enzimas – a região em forma de bolsa onde ocorrem as reações químicas aceleradas – tão poderosos. Embora as estruturas atômicas tridimensionais dos sítios ativos de muitas enzimas tenham sido visualizadas e mapeadas, a estrutura "invisível" dos campos elétricos dentro de um sítio ativo é praticamente desconhecida. Esses campos elétricos são teorizados para desempenhar um papel importante na formação de um ambiente preciso em sítios ativos onde as moléculas reagem e transitam rapidamente para novas moléculas.
Agora, um estudo co-liderado pelos pesquisadores de Stanford Chu Zheng e Yuezhi Mao estreou uma nova sonda para medir e visualizar os campos elétricos dentro do sítio ativo de uma enzima. O artigo, publicado recentemente na revista
Nature Chemistry , relata a orientação dos campos elétricos no local da reação e pode ajudar os pesquisadores a calcular as principais interações químicas nos locais ativos. Esses insights, por sua vez, podem levar à construção de enzimas sintéticas personalizadas para a indústria, além de avançar muito na descoberta e no design de novos medicamentos que interferem ou modulam a função dos alvos enzimáticos.
“Desenvolvemos uma nova sonda que pode nos fornecer informações importantes sobre como os campos elétricos são orientados de maneira única nas enzimas, o que achamos fundamental para o incrível poder catalítico das enzimas”, disse Zheng, estudante de pós-graduação no laboratório de Steven G. Boxer, professor de química Camille Dreyfus.
“Em um nível básico, estamos tentando entender melhor como as enzimas funcionam e, neste estudo, estamos adicionando uma nova dimensão, trazendo orientações de campo elétrico que se acredita terem um impacto crítico nas funções catalíticas das enzimas”, disse Mao, um estudioso de pós-doutorado em química que trabalha no laboratório de Thomas Markland, professor associado de química em Stanford e também coautor sênior.
Uma nova ferramenta poderosa O laboratório Boxer em Stanford foi pioneiro no conceito de interpretar a funcionalidade das enzimas medindo interações eletrostáticas, que estão presentes em todas as formas de matéria e são organizadas especificamente em três dimensões em grandes moléculas biológicas.
“A origem da incrível funcionalidade das enzimas é uma questão geral e se aplica não apenas à catálise biológica, mas também à catálise química – que é um grande negócio”, disse Boxer. "Aproximadamente 80 por cento de todos os produtos químicos são feitos usando catalisadores, mas o que é realmente responsável por diminuir a energia livre de ativação [para fazer a reação ocorrer mais rápido] não é bem compreendido para a maioria das reações. Investigar o papel dos campos elétricos na função enzimática é muito muito no centro de nosso trabalho", disse Boxer, presidente do Departamento de Química da Escola de Humanidades e Ciências de Stanford e coautor sênior do estudo.
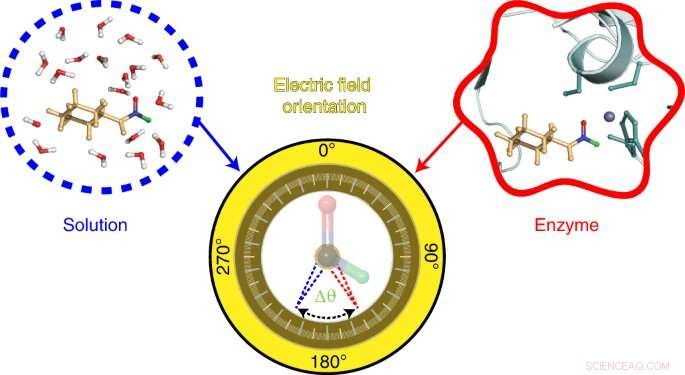
A sonda desenvolvida pela equipe de Stanford conta com uma técnica – também desenvolvida no laboratório Boxer – chamada espectroscopia de efeito Stark vibracional. Essa técnica mede as frequências vibracionais nas moléculas da sonda com base no comprimento de onda da luz infravermelha absorvida por suas ligações químicas. Mudanças nessas frequências vibracionais revelam informações sobre os campos elétricos presentes. Neste estudo, os pesquisadores investigaram mudanças nas frequências vibracionais de ligações químicas em uma sonda feita de uma molécula chamada N-ciclohexilformamida. Esta molécula atua como um inibidor, ligando-se ao sítio ativo de uma enzima chamada álcool desidrogenase hepática.
Para visualizar o campo elétrico no sítio ativo da álcool desidrogenase hepática, os pesquisadores direcionaram duas ligações na sonda N-ciclohexilformamida a cerca de 120 graus de distância uma da outra. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work."
+ Explorar mais An enzyme's evolution from changing electric fields and resisting antibiotics
