Uma mudança na conformação do sítio ativo transforma o citocromo c de um lançador de elétrons na respiração em uma enzima peroxidase para apoptose. Crédito:(c) Ciência 23 de junho de 2017:Vol. 356, Edição 6344, pp. 1236, DOI:10.1126 / science.aan5587
(Phys.org) —Uma equipe de pesquisadores da Universidade de Stanford usou absorção ultrarrápida de raios-X e espectroscopia de emissão para quantificar o estado entático do citocromo c. Em seu artigo publicado na revista Ciência , o grupo descreve seu procedimento e o que aprenderam. Kara Bren e Emma Raven com a University of Rochester e a University of Leicester, respectivamente, oferecem um artigo de Perspectiva sobre o trabalho realizado pela equipe na mesma edição da revista, e delinear algumas das implicações sobre o papel que a proteína desempenha na vida e morte celular.
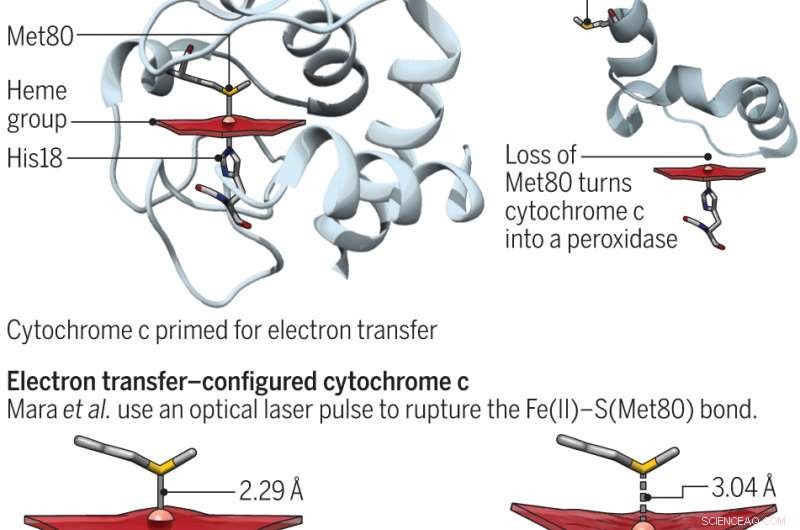
O citocromo c é uma proteína que existe em muitas plantas, animais e organismos unicelulares. Em humanos, seus principais objetivos são transportar elétrons na mitocôndria e auxiliar na apoptose (morte celular normal e os processos que a cercam). Essas duas funções foram mostradas em esforços anteriores para depender da posição do resíduo de metionina. Quando o enxofre funciona com o ferro, a proteína está pronta para transferir elétrons. De outra forma, ele se envolve em atividades de peroxidase. Neste novo esforço, os pesquisadores buscaram entender melhor a energética da proteína sondando a ligação ferro e enxofre. Estados entáticos, Bren e Raven apontam, são muito importantes na química bioinorgânica - na verdade, se traduz em algo que é esticado quando sujeito à tensão.
Para entender melhor a ligação entre os dois elementos, os pesquisadores os separaram temporariamente usando um laser de elétrons livre de raios-X Linac Coherent Light Source e, em seguida, cronometraram quanto tempo levou para os dois componentes se reformarem usando espectroscopia de emissão de raios-X de ferro. Eles descobriram que o ambiente em que existiam aumentava a resistência da ligação em quatro quilocalorias por mol, o que foi suficiente para permitir que a proteína alternasse entre seus estados funcionais e para quantificar o custo de energia do estado entático.
Como observam Bren e Raven, os resultados do estudo têm implicações sobre o papel que o citocromo desempenha na respiração, que eles se relacionam com a vida e apoptose, que eles se relacionam com a morte. Para promover uma vida contínua, a proteína ajuda a manter um certo potencial de redução. Para apoptose, o estado entático é interrompido permitindo que a atividade da peroxidase seja aumentada.
© 2017 Phys.org