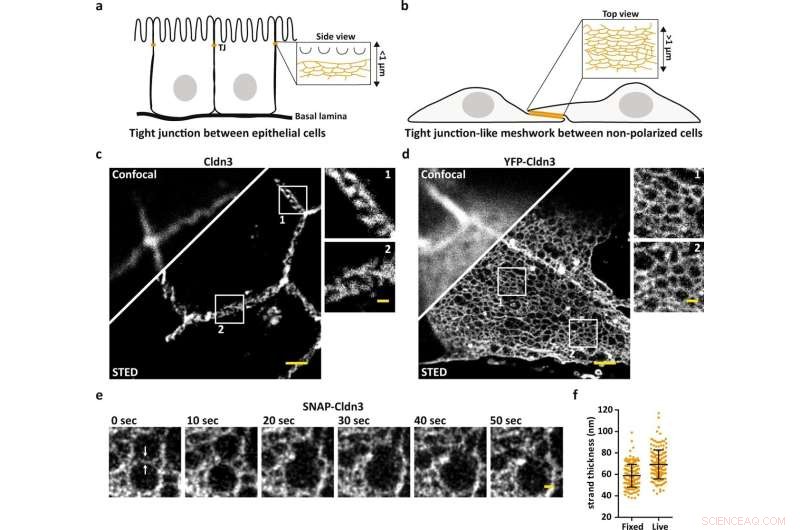
A microscopia STED revela a organização em nanoescala das malhas TJ. a Esquema ilustrando a TJ endógena no contato célula a célula mais apical em células epiteliais. b Esquema ilustrando a malha tipo TJ formada em áreas planas sobrepostas de células não polarizadas transfectadas com claudina. c, d Imagem confocal e STED representativa de um TJ formado endógeno marcado para Cldn3 (2nd-Atto647N) entre células epiteliais do tecido do duodeno de camundongo (c) e malha semelhante a TJ formada por YFP-Cldn3 superexpresso (α-GFP-NB- Atto647N) entre duas células COS-7 (d). e Séries temporais STED de cor única representativas (1 quadro/10 s) de uma malha tipo TJ em uma região sobreposta de células COS-7 vivas que expressam SNAP-Cldn3 (BG-JF646). As setas brancas indicam a quebra inicial da fita seguida pela fusão de duas malhas menores em uma malha maior. Foi aplicado um desfoque gaussiano com um sigma de 20 nm. f Medição de meia-máxima de largura total (FWHM) de fitas TJ de SNAP-Cldn3 (BG-JF646) em células COS-7 fixas e vivas. Os dados representam a média ± SD. Cada ponto de dados representa um perfil de linha de um total de 160 perfis de linha de 8 malhas independentes do tipo TJ (n = 160). O FWHM geral resultou em 59 ± 11 nm para amostras fixas e em 69 ± 14 nm para amostras vivas. Todas as imagens representativas derivam de 3 experimentos independentes. Barras de escala, 1 µm (c, d) e 200 nm (ampliações em c, d e e). Crédito:Comunicação da Natureza (2022). DOI:10.1038/s41467-022-32533-4
Eles selam as células epiteliais e, sob certas condições, permitem a passagem de íons e água:as junções estreitas formam uma barreira paracelular nos tecidos e sua disfunção está associada a doenças. Embora seus componentes moleculares sejam conhecidos desde a década de 1990, não é aparente como as 26 proteínas chamadas claudinas estão organizadas.
Cientistas do Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) agora obtiveram informações profundas sobre a estrutura das junções apertadas, usando microscopia de depleção de emissão estimulada de super-resolução (STED). É a primeira vez que o mecanismo básico subjacente a todas as propriedades de barreira epitelial foi descrito.
As junções estreitas (TJ) são normalmente excelentes para permitir a passagem de íons ou moléculas necessárias, enquanto formam uma barreira densa para evitar que bactérias indesejadas e suas toxinas entrem no corpo. Essas barreiras paracelulares, que podem ser simultaneamente canais seletivos de íons e água, são encontradas onde as células epiteliais ou células endoteliais se encontram, ou seja, onde diferentes tecidos estão conectados uns aos outros ou quando o lúmen de um órgão precisa ser selado da corrente sanguínea.
A existência de junções apertadas foi descoberta há cerca de 60 anos, e seus principais componentes moleculares são conhecidos há 30 anos:26 proteínas de membrana chamadas claudinas. Dependendo da célula, as claudinas são organizadas em várias constelações para formar malhas semipermeáveis de até várias centenas de nanômetros de largura. Normalmente, várias claudinas se juntam, mas algumas barreiras consistem em apenas uma ou duas proteínas estruturais.
Mas a questão é:como as claudinas são organizadas para criar diferentes propriedades de barreira dependendo da célula ou tecido em questão? E até que ponto as claudinas dependem umas das outras no processo? Até agora, essas perguntas permaneceram sem resposta porque era impossível ver através da estrutura dos fios, que têm apenas cerca de dez nanômetros de espessura. Agora, os cientistas da FMP conseguiram fazer exatamente isso usando a microscopia STED.
"Este tipo de microscopia de super-resolução e uma excelente equipe de biólogos celulares, cientistas da computação e fisiologistas nos ajudaram a esclarecer a arquitetura molecular das junções apertadas", disse o Dr. Martin Lehmann, chefe do Cellular Imaging Group, último autor de o estudo. "Agora, pela primeira vez, conseguimos descrever o mecanismo subjacente às principais propriedades da barreira epitelial".
Usando STED para resolver malhas únicas Normalmente, a resolução dos microscópios de fluorescência é limitada a cerca de 250 nanômetros. Usando microscopia STED, 50 nanômetros ou menos são possíveis. Isso literalmente deu aos pesquisadores uma visão maior.
"Com a microscopia de fluorescência padrão, nunca teríamos penetrado na organização densa da junção apertada, mas o STED nos permitiu resolver as malhas individuais da rede. Como resultado, agora podemos determinar a posição exata das proteínas, como bem como para ver se as claudinas se misturam ou se separam, e como elas segregam", afirma Hannes Gonschior, o primeiro autor do estudo, que conduziu seu doutorado. tese sobre o tema na FMP. "Esta organização em nanoescala era anteriormente desconhecida."
Primeiramente, os estudos foram realizados em nível celular, e depois em tecido intestinal e renal de camundongos. Imagens impressionantes reproduziram as proteínas marcadas com fluorescência em cores diferentes, mostrando onde quais proteínas estão localizadas e como elas se encadeiam para formar um zíper colorido.
Três descobertas do estudo, agora publicado na
Nature Communications , merecem destaque:
- Primeiro:as claudinas selam os espaços intercelulares para íons e pequenas moléculas – como um zíper. Essas vedações são seletivamente permeáveis a íons, dependendo do tecido e da composição da junção estreita.
- Segundo:uma em cada duas claudinas é incapaz de polimerizar em filamentos. Eles dependem de outros membros da equipe para formar e "funcionalizar" uma junção estreita.
- Terceiro:Claudins interagem uns com os outros em cinco princípios de organização. Isso significa que existem cinco maneiras diferentes de misturar ou separar.
Criação de modelo para descoberta de medicamentos O fato de os pesquisadores da FMP terem sido capazes de determinar a organização em nanoescala de junções estreitas pela primeira vez é um grande sucesso para a pesquisa básica. Mas a medicina também pode se beneficiar do avanço. Isso ocorre porque as mutações nas claudinas desempenham um papel em várias doenças hereditárias, sendo a mais óbvia a síndrome HELIX – uma condição rara que causa redução na produção de suor.
Uma mutação na claudina 10b é a culpada, causando hipoidrose e defeitos nas glândulas lacrimais e salivares, bem como deficiência na regulação do cálcio e magnésio no rim. A equipe de pesquisadores também havia experimentado essa doença mutante.
"Nossa pesquisa ainda está longe de ter relevância clínica", afirmou o biofísico Martin Lehmann, avaliando suas descobertas. "Mas pelo menos agora entendemos como essas malhas estão estruturadas. Este é o primeiro passo, que nos permitirá buscar pequenas moléculas que abrem ou fecham essas barreiras."
O biólogo celular Hannes Gonschior acrescentou que eles "encontraram um modelo simplificado para a descoberta de drogas e, de forma mais geral, conduziram pesquisas sobre a passagem paracelular de íons. É muito provável que nossas descobertas nos permitam entender fenótipos e sintomas clínicos anteriormente inexplicáveis - com um defeito em uma dessas barreiras paracelulares particulares."
+ Explorar mais Fechando a lacuna:um mecanismo de duas camadas para a barreira epitelial
