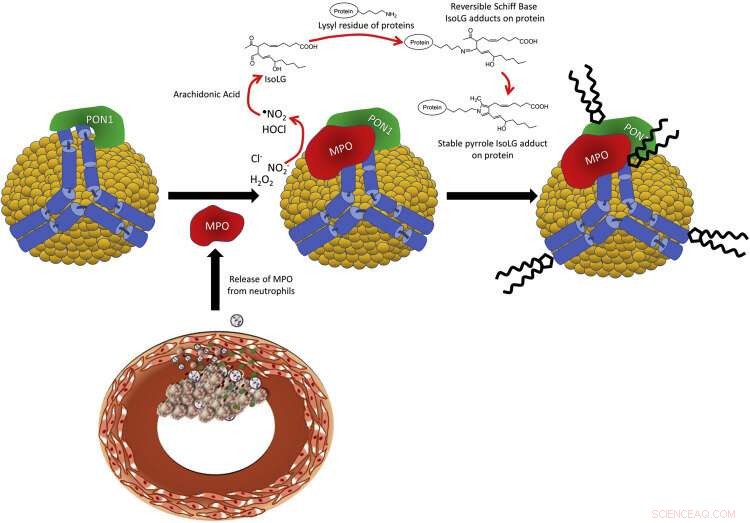
Figura 1. Esquema da interação PON1 / MPO com apoA-I em HDL e a produção de IsoLG. Neutrófilos ativados no local das lesões ateroscleróticas liberam MPO, que se associa com HDL circulante. MPO forma um complexo ternário com apoA-I e PON1. MPO catalisa a formação de espécies reativas de oxigênio, como hipoclorito, que peroxidiza o ácido araquidônico para formar IsoLG. IsoLG reage extremamente rapidamente com aminas primárias, como os resíduos de lisil de proteínas HDL, como apoA-I, para formar adutos covalentes. Crédito:DOI:10.1016 / j.jbc.2021.101019
PON1 (paraoxonase 1), uma enzima associada à lipoproteína de alta densidade (HDL), decompõe os peróxidos lipídicos, moléculas de gordura altamente reativas que podem danificar os vasos sanguíneos.
Desta maneira, PON1 pode proteger contra o desenvolvimento de doenças cardiovasculares. Numerosos estudos observaram redução da atividade enzimática de PON1 em pacientes com doença cardiovascular.
Relatórios no mês passado no Journal of Biological Chemistry , Sean Davies, Ph.D., e colegas demonstraram in vitro que outras moléculas reativas chamadas isolevuglandinas (IsoLGs) podem modificar diretamente PON1, e essa modificação direta é o mecanismo principal pelo qual o IsoLG reduz a atividade de PON1.
Em colaboração com MacRae Linton, MD, e colegas, O grupo theDavies mostrou anteriormente em um modelo de camundongo que as moléculas eliminadoras que se ligam e removem IsoLGs da corrente sanguínea aumentaram significativamente a atividade de PON1.
Embora mais estudos in vivo sejam necessários para determinar até que ponto a modificação IsoLG de PON1 contribui para a redução da atividade enzimática, o estudo atual apóia a noção de que bloquear essa modificação pode ser benéfico para reduzir a aterosclerose, concluíram os pesquisadores.