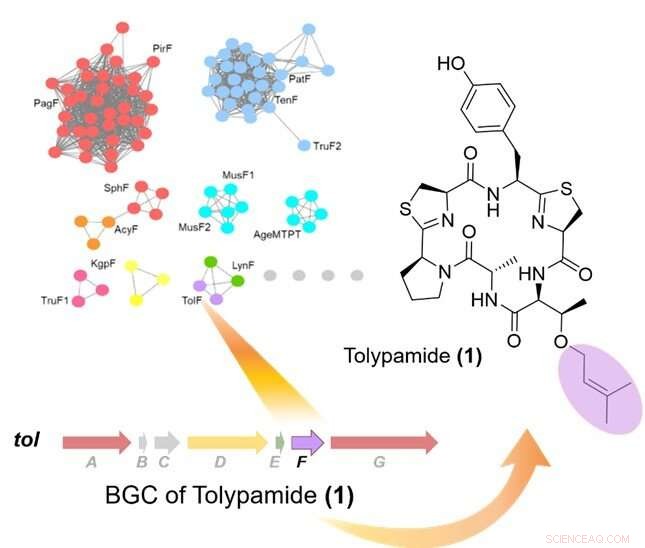
 p Figura 1:Mineração do genoma direcionado de preniltransferases identificou a enzima TolF e o para mim cluster de genes biossintéticos (BGC). O canto superior esquerdo mostra uma rede de similaridade de sequência de proteínas de preniltransferases. O cluster de genes biossintéticos para o para mim via é mostrada e estava ligada à biossíntese da tolipamida. A tolipamida contém um resíduo de treonina prenilada direta (colorido em roxo). Crédito:Universidade Nacional de Cingapura
p Figura 1:Mineração do genoma direcionado de preniltransferases identificou a enzima TolF e o para mim cluster de genes biossintéticos (BGC). O canto superior esquerdo mostra uma rede de similaridade de sequência de proteínas de preniltransferases. O cluster de genes biossintéticos para o para mim via é mostrada e estava ligada à biossíntese da tolipamida. A tolipamida contém um resíduo de treonina prenilada direta (colorido em roxo). Crédito:Universidade Nacional de Cingapura
p Os pesquisadores da NUS usaram uma abordagem de mineração do genoma para identificar um novo peptídeo cíclico (tolipamida) derivado de uma cianobactéria. A biossíntese da tolipamida apresenta um novo tipo de enzima que é capaz de prenilar uma variedade de substratos e tem uso potencial em química farmacêutica e biologia sintética. p Os peptídeos bioativos garantiram uma posição forte no mercado farmacêutico devido às inúmeras vantagens, como o direcionamento eficaz das interações proteína-proteína, baixos efeitos fora do alvo, e baixa toxicidade. Essas vantagens são frequentemente comprometidas devido à baixa biodisponibilidade e permeabilidade celular. Uma maneira de melhorar a permeabilidade da membrana é aumentar a lipofilicidade anexando uma cadeia alquil à molécula (prenilação). Essas transformações, que pode ser catalisada por enzimas envolvidas na biossíntese de produtos naturais de cianobactina, pode potencialmente aumentar a eficácia terapêutica de peptídeos não modificados. Também, As enzimas cianobactinas têm ampla seletividade de substrato e atuam de maneira altamente seletiva e específica no que diz respeito à posição e orientação dos resíduos de aminoácidos. Compreender a lógica por trás da seletividade e especificidade desses catalisadores ajudará a aproveitar a capacidade dessas enzimas como kits de ferramentas bioquímicas.
p Em colaboração com uma equipe de pesquisa internacional, Prof Brandon Morinaka do Departamento de Farmácia, A Universidade Nacional de Cingapura descobriu um novo tipo de enzima cianobactina conhecida como ToIF. Exibe seletividade específica para a modificação de resíduos de serina e treonina em peptídeos. Este trabalho é um esforço de pesquisa conjunto com o Prof Eric Schmidt da Universidade de Utah e o Dr. Muriel Gugger do Institut Pasteur. As proteínas de uma subfamília de preniltransferases foram mapeadas em uma rede de similaridade de sequência.
p Os pesquisadores aplicaram a mineração do genoma direcionado para analisar os agrupamentos de genes que codificam essas proteínas e identificaram a enzima ToIF e a via biossintética tol. Eles descobriram que a enzima TolF está envolvida na produção de tolipamida, que tem um grupo funcional prenil hidrofóbico ligado à sua estrutura (Figura 1). Tais ligações moleculares são úteis para melhorar a permeabilidade da membrana de compostos terapêuticos. A enzima TolF foi validada funcionalmente pela biossíntese in vitro do produto natural de polipamida (Figura 2). Ensaios bioquímicos adicionais mostram que a enzima TolF também é capaz de facilitar a prenilação direta nos resíduos de treonina e serina em vários peptídeos sintéticos.
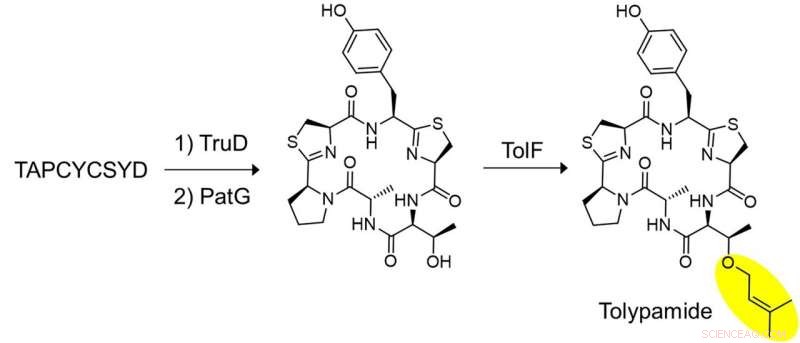 p Figura 2:Biossíntese in vitro de polipamida e validação funcional de TolF. Um conjunto chave de experimentos foi realizado para mostrar que TolF atua no peptídeo cíclico heterociclizado. O peptídeo sintetizado, TAPCYCSYD foi incubado sequencialmente com as enzimas, TruD (heterociclase) e PatG (macrociclase) para fornecer o peptídeo cíclico heterociclizado. A incubação com TolF deu conversão quantitativa ao produto natural tolipamida. Crédito:Universidade Nacional de Cingapura
p Figura 2:Biossíntese in vitro de polipamida e validação funcional de TolF. Um conjunto chave de experimentos foi realizado para mostrar que TolF atua no peptídeo cíclico heterociclizado. O peptídeo sintetizado, TAPCYCSYD foi incubado sequencialmente com as enzimas, TruD (heterociclase) e PatG (macrociclase) para fornecer o peptídeo cíclico heterociclizado. A incubação com TolF deu conversão quantitativa ao produto natural tolipamida. Crédito:Universidade Nacional de Cingapura
p A data, o único outro membro desta classe de enzimas (preniltransferase) identificado para agir em resíduos de serina ou treonina é TruF1. Contudo, sua baixa solubilidade e baixa atividade in vitro impediram uma extensa caracterização. A descoberta do TolF oferece uma oportunidade de estudar a biologia estrutural e a evolução desta família de enzimas.
p Prof Morinaka disse, "A caracterização adicional da enzima TolF permitirá uma compreensão mais completa da especificidade do substrato e seletividade das preniltransferases. Isso facilitará a engenharia racional desses biocatalisadores como ferramentas poderosas no campo da biologia sintética."

