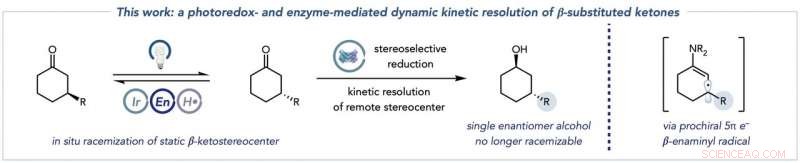
 p A transformação geral combinando a racemização dos substratos cetônicos (à esquerda) com a redução biocatalítica em produtos de álcool enantiomericamente puros (centro), e a espécie de radical enaminil chave que essa química desbloqueia para permitir a racemização de β-cetostereocentros estáticos (à direita). Crédito:Jacob DeHovitz
p A transformação geral combinando a racemização dos substratos cetônicos (à esquerda) com a redução biocatalítica em produtos de álcool enantiomericamente puros (centro), e a espécie de radical enaminil chave que essa química desbloqueia para permitir a racemização de β-cetostereocentros estáticos (à direita). Crédito:Jacob DeHovitz
p Uma colaboração entre dois laboratórios do Departamento de Química da Universidade de Princeton produziu uma nova plataforma impressionante que permite aos químicos reinterpretar as regras da estereoquímica e do estereocontrole com implicações importantes para as indústrias farmacêutica e agroquímica. p A pesquisa demonstra a capacidade da catálise fotoredox de tomar estereocentros tradicionalmente estáticos e torná-los dinâmicos, quebrando e reformando ligações moleculares de forma contínua e controlável. É uma promessa para os cientistas definirem os estereocentros de um complexo composto alvo de forma sucinta, passo eficiente em vez de um estereocentro de cada vez. (Um estereocentro dá uma assimetria de imagem de espelho de molécula, que é importante para determinar as propriedades biologicamente ativas durante a síntese.)
p A colaboração combina a experiência do laboratório MacMillan e do laboratório Hyster. O papel, "Estereocontrole estático para indutivelmente dinâmico:o uso convergente de cetonas substituídas por β racêmicas, " aparece em
Ciência esta semana.
p "Normalmente, quando você está pensando em construir moléculas com estereocentros nelas, você pensa em definir o estereocentro no evento de formação de vínculo, "disse Todd Hyster, professor assistente de química. "E o que descobrimos é que, se você usar catálise fotorredox, você pode essencialmente desbloquear mecanismos para criar estereocentros que, de outra forma, seriam estáticos, ou fixo. Você pode torná-los dinâmicos.
p "Quando você acopla aqueles com enzimas altamente seletivas, você pode pensar em construir moléculas estereoquimicamente complexas de maneiras completamente novas. "
p A estereoquímica envolve o arranjo espacial dos átomos e como eles podem ser manipulados na estrutura molecular para os resultados desejados. Deriva do fato de que o carbono tem quatro substituintes. Esses quatro substituintes são diferentes; eles têm que existir como imagens no espelho um do outro. Essas imagens de espelho são chamadas de enantiômeros. Nossas mãos são enantiômeros, por exemplo; eles são imagens espelhadas um do outro. O que isso significa na prática é que eles não podem ser sobrepostos - uma luva esquerda não cabe na mão direita.
p O corpo humano responde aos medicamentos exatamente da mesma maneira. Nossa matéria biológica é composta de uma série de imagens especulares e não da outra. O corpo pode reconhecer a diferença entre dois medicamentos que parecem idênticos, embora um seja uma imagem no espelho e o outro não. Esse reconhecimento influencia a aceitação e, portanto, a eficácia das terapias.
p O que a pesquisa de MacMillan e Hyster descobriu é uma maneira de desacoplar a configuração do estereocentro da etapa em que é formado, ou racemizado. Ser capaz de controlar essa racemização é importante para o desenvolvimento dos medicamentos mais eficazes.
p "Existem muitos, muitas razões pelas quais esta é uma pesquisa estimulante, não menos importante, você pode basicamente fazer uma molécula e dizer:talvez eu realmente queira mudar esse estereocentro para transformá-lo em outra coisa. Você pode realmente voltar e fazer isso, "disse David MacMillan, o distinto professor de química da Universidade James S. McDonnell. "Isso é algo que não achamos que tenha sido feito dessa forma antes na química orgânica e, portanto, abre algumas oportunidades notáveis."
p
Enzimas impulsionam os resultados
p Foi a introdução de enzimas altamente seletivas no processo que impulsionou os avanços da investigação de "B + para A +", Disse MacMillan.
p "As enzimas têm essa forma de transmitir o que é chamado de estereocontrole, ou a introdução de formas muito específicas para fazer química que catalisadores comuns simplesmente não podem fazer, "disse ele." Ao reunir essas duas ideias, permite uma abordagem completamente nova de como você constrói a estereoquímica. "
p Há muita coisa acontecendo sob o capô neste processo. Quando os cientistas sintetizam um composto com vários estereocentros, eles pressupõem que o centro não pode girar ou se tornar dinâmico uma vez que esteja "colocado". As moléculas são sintetizadas sequencialmente:um centro é formado, e então está bloqueado; e então outro é formado, e então está bloqueado, e assim por diante.
p Jacob DeHovitz, um estudante de graduação do quinto ano no laboratório Hyster e autor principal do artigo, explicou como a reação descrita nesta pesquisa permite aos cientistas desbloquear essa configuração.
p Existem duas partes importantes na reação. Na primeira metade, duas espécies-chave são formadas a partir de um material de partida cetona. A primeira espécie é chamada de enamina, fundamental porque pode ser direcionado pelo catalisador fotoredox. Uma segunda espécie - um radical enaminil - resulta dessa etapa, e destrói o estereocentro molecular original e configura a próxima etapa do processo.
p "A segunda metade é a reação biocatalítica. A enzima em solução - neste caso, principalmente cetoredutases - reduz um desses enantiômeros de cetona, que novamente estão constantemente racemizando em solução, para formar um produto de álcool que não pode sofrer racemização nas nossas condições. Criticamente, o outro enantiômero cetônico não reage com a cetoredutase porque não se ajusta ao sítio ativo da enzima. Essa tendência para um enantiômero é importante porque impede a cetoredutase da formação indesejável de outros estereoisômeros de álcool.
p "Se a reação biocatalítica for combinada com as novas condições de racemização, onde os enantiômeros do material de partida estão constantemente racemizando, então, um químico pode teoricamente pagar até 100% do produto desejado, dobrando a eficiência, "DeHovitz disse.
p Esta pesquisa representa três anos de investigação colaborativa pelos dois laboratórios.
